Liens de la barre de menu commune
(Note : Le contenu de cette page risque d'être plus large que d'habitude.)
Guide de l’utilisateur des données de l’Enquête canadienne sur les mesures de la santé (ECMS) : cycle 1
Avril 2011
Remerciements
Statistique Canada dépend dans une large mesure de la collaboration et de la bonne volonté des participants qui consacrent du temps aux enquêtes. C’est pourquoi l’équipe de l’Enquête canadienne sur les mesures de la santé (ECMS) est très reconnaissante aux participants de l’aider à recueillir des données clés concernant la santé des Canadiens. Ces données contribueront à la prise de décisions qui orienteront les politiques en matière de santé et les programmes de santé publique qui toucheront les Canadiens au cours des années à venir.
Statistique Canada et l’équipe de l’ECMS aimeraient aussi remercier leurs partenaires, Santé Canada et l’Agence de la santé publique du Canada, pour leur soutien, leur collaboration et leurs conseils.
Au nom de toutes les personnes qui collaborent à l’ECMS, Statistique Canada aimerait exprimer ses remerciements sincères pour le temps, les efforts et l’expertise fournis par les membres des comités consultatifs de l’ECMS relativement à l’élaboration de cette enquête unique et innovatrice.
Nous aimerions aussi remercier tous ceux qui ont contribué à la production du présent document.
Table des matières
1. Introduction
2. Contexte et objectifs de l’Enquête canadienne sur les mesures de la santé (ECMS)
2.1 Contexte de l’ECMS
2.2 Objectifs de l’ECMS
3. Approbation de l’enquête
3.1 Autorité
3.2 Protocoles éthiques et normes de protection de la vie privée
4. Contenu de l’enquête
5. Plan d’échantillonnage
5.1 Population cible
5.2 Taille et répartition de l’échantillon.
5.3 Bases de sondage et stratégie d’échantillonnage
5.3.1 Échantillonnage des sites de collecte
5.3.2 Échantillonnage des logements
5.3.2.1 Sous-échantillonnage des répondants à jeun
5.3.2.2 Sous-échantillonnage de l’éther diphénylique polybromé (EDP)/des biphényles polychlorés (BPC)
5.3.2.3 Sous-échantillonnage du mercure inorganique
5.3.2.4 Sous-échantillonnage des composés perfluorés
5.3.2.5 Sous-échantillonnage des phtalates
5.3.3 Échantillonnage des personnes
5.3.3.1 Sous échantillonnage des moniteurs d'activité
5.3.3.2 Sous échantillonnage du tabac
6. Collecte des données
6.1 Préparation en vue de la collecte
6.1.1 Équipe de l’Enquête canadienne sur les mesures de la santé (ECMS)
6.1.1.1 Équipe sur le terrain
6.1.1.2 Équipe du centre d’examen mobile (CEM)
6.1.1.3 Personnel du bureau central
6.1.2 Centre d’examen mobile (CEM)
6.1.3 Environnement informatique
6.1.4 Conception du questionnaire
6.1.4.1 Questionnaire auprès des ménages
6.1.4.2 Questionnaire de la partie clinique
6.1.4.3 Essai
6.2 Collecte
6.2.1 Collecte — Interview auprès des ménages
6.2.2 Collecte — Centre d’examen mobile (CEM)
6.2.3 Collecte — Visite à domicile
6.3 Réduction de la non‑réponse
6.3.1 Réduction de la non‑réponse — Interview auprès des ménages
6.3.1.1 Lettres de présentation et dépliants
6.3.1.2 Établissement du contact
6.3.1.3 Procédures de refus — Interview auprès des ménages
6.3.1.4 Obstacles linguistiques — Interview auprès des ménages
6.3.1.5 Jeunes répondants — Interview auprès des ménages
6.3.1.6 Interviews par procuration
6.3.2 Réduction de la non‑réponse — Centre d’examen mobile (CEM)
6.3.2.1 Suivi de la non‑réponse
6.3.2.2 Souplesse de l’horaire du CEM
6.3.2.3 Procédures de refus — CEM
6.3.2.4 Obstacles linguistiques — CEM
6.3.2.5 Jeunes répondants — CEM
6.4 Protocoles des mesures au centre d’examen mobile (CEM)
6.4.1 Anthropométrie
6.4.1.1 Taille en position debout
6.4.1.2 Taille en position assise
6.4.1.3 Poids
6.4.1.4 Circonférence de la taille
6.4.1.5 Circonférence des hanches
6.4.1.6 Plis cutanés
6.4.2 Fréquence cardiaque et tension artérielle
6.4.3 Spirométrie
6.4.4 Aptitudes musculosquelettiques
6.4.4.1 Composante de la force de préhension
6.4.4.2 Composante de la flexion du tronc
6.4.4.3 Composante des redressements assis partiels
6.4.5 Composante du Physitest aérobie canadien modifié (PACm)
6.4.6 Composante de la santé bucco-dentaire
6.4.7 Moniteur d'activité physique
6.5 Protocoles des mesures de laboratoire
6.5.1 Prélèvement des échantillons
6.5.1.1 Prélèvement des échantillons de sang
6.5.1.2 Prélèvement des échantillons d’urine
6.5.2 Analyse de l’hémogramme effectué au centre d’examen mobile (CEM)
6.5.3 Traitement et entreposage des échantillons de sang et d’urine
6.5.4 Expédition
7. Traitement des données
7.1 Vérification
7.2 Les questions pour lesquelles toutes les réponses appropriées doivent être choisies
7.3 Codage
7.4 Vérification
7.5 Création de variables dérivées
7.6 Limite de détection
7.7 Intervalle de référence
8. Structure des fichiers de données
8.1 Description des fichiers de données
8.1.1 Vague 1 : Fichier maître
8.1.2 Vague 2 : Fichier maître
8.1.3 Vague 2 : Sous-échantillon des répondants à jeun
8.1.4 Vague 3 : Fichier maître
8.1.5 Vague 3 : Fichiers de sous-échantillon
8.1.6 Vague 4 : Fichier maître
8.1.7 Vague 4 : Fichier de sous-échantillon
8.1.8 Diffusion des données supplémentaire : Fichier principal
8.1.9 Diffusion des données supplémentaire : Fichier sur les médicaments
8.1.10 Diffusion des données supplémentaire : Fichiers de sous-échantillon
8.2 Variables clés pour le couplage des fichiers de données
8.3 Variables clés et définitions
9. Pondération
9.1 Poids de sélection des sites de collecte
9.2 Poids de sélection des logements
9.3 Retrait des unités hors champ
9.4 Non-réponse au niveau du ménage
9.5 Création du poids affecté aux personnes
9.6 Non-réponse au niveau du questionnaire
9.7 Non-réponse au niveau du centre d’examen mobile (CEM)
9.8 Winsorization
9.9 Calage aux marges
9.10 Sous-échantillon de personnes à jeun
9.11 Sous-échantillon de l’éther diphénylique polybromé (EDP)/des biphényles polychlorés (BPC)
9.12 Sous-échantillon du mercure inorganique
9.13 Sous-échantillon des composés perfluorés
9.14 Pondération des moniteurs d'activité
9.15 Sous-échantillon des phtalates
9.16 Sous-échantillon du tabac
10. Qualité des données
10.1 Taux de réponse
10.1.1 Taux de réponse des prélèvements de sang et d’urine
10.1.2 Taux de réponse pour le sous-échantillon de personnes à jeun
10.1.3 Taux de réponse du sous-échantillon de l’éther diphénylique polybromé (EDP)/des biphényles polychlorés (BPC)
10.1.4 Taux de réponse du sous‑échantillon du mercure inorganique
10.1.5 Taux de réponse du sous-échantillon des composés perfluorés
10.1.6 Taux de réponse pour les moniteurs d'activité
10.1.7 Taux de réponse du sous-échantillon des phtalates
10.1.8 Taux de réponse du sous-échantillon du tabac
10.2 Erreurs dans les enquêtes
10.2.1 Erreurs non dues à l’échantillonnage
10.2.2 Erreurs dues à l’échantillonnage
10.3 Assurance et contrôle de la qualité
10.3.1 Formation du personnel chargé des interviews auprès des ménages et du centre d’examen mobile (CEM)
10.3.1.1 Formation initiale
10.3.1.2 Répétition générale
10.3.1.3 Formation continue — Jour de l’exercice d’essai
10.3.1.4 Formation d’appoint annuelle
10.3.2 Composante des ménages
10.3.2.1 Contrôle — Interview auprès des ménages
10.3.2.2 Taux de réponse au questionnaire auprès des ménages
10.3.2.3 Validation des réponses au questionnaire
10.3.3 Composante du centre d’examen mobile (CEM)
10.3.3.1 Sélection de l’équipement
10.3.3.2 Protocoles et procédures
10.3.3.3 Environnement du CEM
10.3.3.4 Respect des lignes directrices à suivre avant les tests
10.3.3.5 Contrôle de l’équipement
10.3.3.6 Vérification de l’entrée des données
10.3.3.7 Examen des données de la spirométrie
10.3.3.8 Validation des données
10.3.3.9 Laboratoire du centre d’examen mobile (CEM)
10.3.3.10 Répétition des tests
10.3.3.11 Vérification de la compétence
10.3.3.12 Traitement et entreposage des échantillons de sang et d’urine
10.3.3.13 Expédition
10.3.3.14 Blancs de terrain
10.3.3.15 Examen des données du moniteur d'activité
10.3.4 Bureau central de l'ECMS
10.3.5 Correction du biais
11. Lignes directrices pour la totalisation, l’analyse et la diffusion
11.1 Lignes directrices pour l’arrondissement
11.2 Lignes directrices pour la pondération de l’échantillon en vue de la totalisation
11.3 Variances ou coefficients de variation exacts
11.4 Quelques recommandations pour l’analyse des données du cycle 1 de l’ECMS
12. Utilisation des fichiers
12.1 Utilisation d’une variable de pondération
12.2 Fichier d’Environnement Canada sur le climat et la qualité de l’air
12.3 Convention appliquée pour nommer les variables
12.3.1 Positions 1 à 3 : Nom de la section du module
12.3.2 Position 4 : Remplissage ou type de variable
12.3.3 Positions 6 à 8 : Renvoi à la question
12.4 Accès aux données du fichier maître
12.5 Concordance des variables
12.6 Notes spéciales
13. Références et notes
Annexe 1 : Lignes directrices à suivre avant les tests
Annexe 2 : Critères d’exclusion
Annexe 3 : Q‑AAP
Annexe 4 : Protocoles du cycle 1 de l’Enquête canadienne sur les mesures de la santé (ECMS)
Annexe 5 : Documentation des variables dérivées
Annexe 6 : Questionnaires
Annexe 7 : Cliché d’enregistrement
Annexe 8 : Tableau de concordance
Annexe 9 : Taux de réponse
1. Introduction
L’Enquête canadienne sur les mesures de la santé (ECMS) est une nouvelle enquête exhaustive reposant sur des mesures directes de la santé, qui a été élaborée pour combler des lacunes et des limites importantes dans les données existantes sur la santé. Elle est menée par Statistique Canada, de concert avec Santé Canada et l’Agence de la santé publique du Canada. Les résultats fourniront de l’information exhaustive sur la santé, en vue de faire progresser la surveillance et la recherche en matière de santé au Canada.
Dans le cadre du cycle 1 de l’ECMS, des mesures directes d’indicateurs de la santé et du mieux‑être ont été recueillies auprès d’un échantillon représentatif d’environ 5 600 Canadiens de 6 à 79 ans. L’enquête comprenait une interview à domicile portant sur l’état de santé général, suivie d’une visite à un centre d’examen mobile (CEM). Les laboratoires de référence et le laboratoire du CEM ont analysé les échantillons biologiques en vue de déceler des indicateurs de la santé générale, des problèmes de santé chroniques, des maladies infectieuses et de l’état nutritionnel, ainsi que des biomarqueurs environnementaux.
Le présent document comprend des renseignements à l’intention des utilisateurs des données concernant la complexité des données et les limites qui pourraient avoir un effet sur leur utilisation. Il explique les méthodes et les concepts utilisés pour recueillir les données auprès des ménages, ainsi qu’au CEM. Les sections suivantes du document comprennent des renseignements concernant le traitement des données et la création de variables dérivées. Des renseignements sur la méthode d’échantillonnage et de pondération et des lignes directrices pour la création de totalisations sont aussi inclus pour aider les utilisateurs des données. L’information concernant l’assurance et le contrôle de la qualité sert à décrire les caractéristiques des données qui pourraient limiter leur utilité ou leur interprétation. Le document conclut par une série d’annexes qui fournissent des données de soutien qui seront utiles aux utilisateurs des fichiers de données de l’ECMS.
Toutes les références et les notes se trouvent à la section 13.
Pour plus de renseignements concernant l’Enquête canadienne sur les mesures de la santé :
Numéro sans frais : 1-888-253-1087
Courriel : chms-ecms@statcan.gc.ca
Appareil de télécommunication pour malentendants : 1-866-753-7083
Site Web de Statistique Canada : www.statcan.gc.ca/ecms
2. Contexte et objectifs de l’Enquête canadienne sur les mesures de la santé (ECMS)
2.1 Contexte de l’ECMS
Les décideurs, les ministères provinciaux de la Santé, les chercheurs, ainsi que les professionnels de la santé spécialisés dans divers domaines, ont indiqué la nécessité de disposer d’une source nationale complète de mesures exactes de la santé pour les aider à répondre aux besoins de la population canadienne en matière de santé.
En 2003, Santé Canada et l’Agence de la santé publique du Canada ont appuyé les démarches de Statistique Canada en vue d’obtenir des fonds pour une enquête sur la santé axée sur des « mesures directes », afin de combler des lacunes de longue date du système canadien d’information sur la santé. Le financement a été annoncé dans le budget fédéral de 2003, en tant que prolongement du Carnet de route de l’information sur la santé, et du financement permanent a été obtenu dans le budget fédéral de 2008.
Les renseignements recueillis permettront de produire des données nationales de base qui contribueront à évaluer l’étendue de problèmes de santé majeurs, comme l’obésité, l’hypertension, la maladie cardiovasculaire, l’exposition aux maladies infectieuses et l’exposition aux contaminants présents dans l’environnement. De plus, l’ECMS permettra de mieux connaître certaines maladies et d’avoir une meilleure idée de la proportion de maladies non diagnostiquées chez les Canadiens. L’ECMS nous permettra également d’examiner le lien entre l’état de santé et les facteurs de risque associés à la maladie, et d’explorer les nouveaux enjeux en matière de santé publique.
2.2 Objectifs de l’ECMS
Parmi les objectifs de l’ECMS figurent les suivants :
- estimer le nombre de personnes ayant certains problèmes de santé, caractéristiques et niveaux d’exposition aux contaminants environnementaux, d’après des mesures directes de la santé;
- établir les rapports entre les facteurs de risque, la promotion de la santé et les habitudes de protection, et l’état de santé;
- établir une biobanque d’échantillons biologiques (urine, sang, ADN [acide désoxyribonucléique]) d’un échantillon représentatif de Canadiens, en vue d’activités futures de recherche et de surveillance.
3. Approbation de l’enquête
3.1 Autorité
Dans le budget fédéral de 2003 prévoyait le financement d’une enquête nationale sur la santé axée sur des « mesures directes », qui devait être menée par Statistique Canada, en partenariat avec Santé Canada et l’Agence de la santé publique du Canada.
L’Enquête canadienne sur les mesures de la santé (ECMS) est une initiative de collecte de données statistiques à des fins de recherche menée en vertu de la Loi sur la statistique fédérale. Statistique Canada peut recueillir des données sur la santé uniquement à cette fin et ne peut pas utiliser ou divulguer les données des participants à une autre fin sans le consentement écrit de ces derniers.
3.2 Protocoles éthiques et normes de protection de la vie privée
Le cycle 1 de l’ECMS a été mené en collaboration avec les administrations provinciales et municipales, avec l’appui d’associations de professionnels de la santé et dans le souci constant de la santé et de la sécurité des Canadiens.
Tous les processus du cycle 1 de l’ECMS ont été passés en revue par le Comité d’éthique de la recherche de Santé Canada, afin d’assurer le respect et le maintien de normes éthiques reconnues au niveau international pour la recherche avec des êtres humains. Par ailleurs, des protocoles ont été élaborés par suite de consultations exhaustives auprès d’experts reconnus et ils ont été exécutés par des professionnels de la santé accrédités, qui ont pris des précautions mondialement reconnues.
La participation à cette enquête était volontaire. Le caractère volontaire de l’enquête a été énoncé dans la lettre de présentation, le dépliant, la vidéo, le Livret d’information et de consentement et la section des questions et réponses de l’ECMS du site Web de Statistique Canada. Les documents ont aussi fait ressortir la sécurité de tous les tests et les normes utilisées à cet égard. Le personnel de l’ECMS a répondu aux questions des répondants concernant les risques liés à la participation aux tests et à l’utilisation de leurs données, dans le cadre d’un processus de consentement interactif en neuf points, tout au long de l’interview sur la santé à domicile et de la visite au centre d’examen mobile.
Plusieurs réunions se sont aussi tenues avec le Commissariat à la protection de la vie privée du Canada et les commissaires provinciaux à la protection de la vie privée concernant les protocoles de l’ECMS, afin que les droits relatifs à la protection des renseignements personnels des participants soient protégés. Une évaluation complète des facteurs relatifs à la vie privée a été menée pour l’ECMS et passée en revue par le Commissariat à la protection de la vie privée du Canada, qui continue d’assurer la supervision de l’ECMS et qui fournit aux participants un moyen de formuler des plaintes et un mécanisme de recours.
4. Contenu de l’enquête
La consultation fait partie intégrante de la planification de l’Enquête canadienne sur les mesures de la santé (ECMS). Statistique Canada a tenu des discussions et des ateliers exhaustifs avec les responsables de nombreux programmes, des groupes, des personnes et des organismes depuis mars 2000 en vue de recueillir de l’information et des commentaires sur le contenu proposé, les besoins de données et les considérations opérationnelles. Parmi les groupes qui ont joué le rôle le plus important dans l’élaboration du contenu figurent Santé Canada, l’Agence de la santé publique du Canada, les responsables de la National Health and Nutrition Examination Survey (NHANES), le Comité consultatif des experts de l’ECMS, le Comité consultatif des médecins de l’ECMS, le Comité consultatif du laboratoire de l’ECMS, le Comité consultatif de l’assurance et du contrôle de la qualité de l’ECMS, le Comité directeur de l’ECMS et le Comité des politiques de Statistique Canada.
Le cycle 1 de l’ECMS comportait une interview auprès des ménages et une visite à un centre d’examen mobile (CEM). L’interview auprès des ménages visait à recueillir des renseignements démographiques généraux et comprenait un questionnaire approfondi sur la santé. La visite au CEM comprenait non seulement des mesures et des tests physiques, mais aussi le prélèvement d’échantillons de sang et d’urine auprès des répondants. Certains échantillons ont été analysés dans le laboratoire du CEM, comme ceux prélevés pour l’hémogramme, qui inclut les plaquettes, la numération érythrocytaire et la numération des globules blancs. Les autres échantillons ont été analysés dans trois laboratoires de référence externes. Enfin, on a demandé aux répondants de porter un moniteur d’activité pendant les sept jours suivant leur visite au CEM.
Les tableaux suivants fournissent des listes détaillées du contenu provenant des ménages, du CEM et des laboratoires pour les diffusions de données du cycle 1 de l’enquête. Les tableaux sont organisés en ordre alphabétique selon des thèmes et des sujets similaires afin de souligner les rapports et les possibilités d’analyse entre les contenus des interviews auprès des ménages, des visites au CEM et des données de laboratoire. Plus de renseignements au sujet de la diffusion des données par vagues de l’ECMS sont fournis au chapitre 8 du présent document.
| Thème | Sujet | Âge des répondants de l’ECMS | * Source (enquêtes de Statistique Canada) |
|---|---|---|---|
| Alcool | Consommation d’alcool | 12 à 79 ans | ESCC 3.1 |
| ENSP, cycle 6 | |||
| Anthropométrie | Taille et poids | 6 à 79 ans | ESCC 3.1 |
| ENSP, cycle 6 | |||
| Changement de poids | 18 à 79 ans | ||
| Problèmes de santé chroniques | Problèmes de santé chroniques | 6 à 79 ans | ESCC 3.1 |
| Phlegme | 6 à 79 ans | ||
| Consommation de drogues/médicaments | Consommation de drogues illicites | 14 à 79 ans | ESCC 3.1 |
| Consommation de médicaments | 6 à 79 ans | ||
| Exposition aux contaminants environnementaux | Utilisation de produits de toilette | 6 à 79 ans | |
| Passe-temps | 6 à 79 ans | ||
| Caractéristiques du logement | 6 à 79 ans | ||
| Antécédents médicaux familiaux | Antécédents médicaux familiaux | 6 à 79 ans | |
| État de santé général | État de santé général | 6 à 79 ans | ESCC 3.1 |
| ENSP, cycle 6 | |||
| Indice de l’état de santé | 6 à 79 ans | ESCC 3.1 | |
| ENSP, cycle 6 | |||
| ELNEJ, cycle 6 | |||
| Points forts et difficultés | 6 à 17 ans | ||
| Marqueurs de maladies infectieuses | Hépatite | 6 à 79 ans | |
| Nutrition | Consommation de matières grasses alimentaires | 6 à 79 ans | |
| Consommation de céréales, de fruits et de légumes | 6 à 79 ans | ||
| Consommation de viande et de poisson | 6 à 79 ans | ||
| Consommation de lait et de produits laitiers | 6 à 79 ans | ||
| Consommation de sel | 6 à 79 ans | ||
| Consommation d’eau et de boissons gazeuses | 6 à 79 ans | ENSP, cycle 6 | |
| Santé bucco-dentaire | Santé bucco-dentaire | 6 à 79 ans | |
| Activités physiques | Activités physiques des enfants | 6 à 11 ans | ESCC 2.2 |
| Activités physiques | 12 à 79 ans | ESCC 3.1 | |
| ENSP, cycle 6 | |||
| Activités sédentaires | 12 à 79 ans | ESCC 3.1 | |
| Grossesse/naissance | Information sur l’accouchement | 6 à 11 ans | ELNEJ, cycle 6 |
| Information sur l’allaitement | 6 à 11 ans | ESCC 3.1 | |
| ELNEJ, cycle 6 | |||
| Allaitement maternel | 14 à 79 ans (F seul.) |
ESCC 3.1 | |
| Grossesse | 14 à 59 ans (F seul.) |
ENSP, cycle 6 | |
| Information sur la grossesse | 6 à 11 ans | ELNEJ, cycle 6 | |
| Santé sexuelle | Comportement sexuel | 14 à 79 ans | ESCC 3.1 |
| Sommeil | Sommeil | 6 à 79 ans | ESCC 3.1 |
| ENSP, cycle 6 | |||
| Usage du tabac | Exposition à la fumée des autres | 6 à 79 ans | ESCC 3.1, |
| ESUTC, cycle 1 | |||
| Usage du tabac | 12 à 79 ans | ESCC 2.2 | |
| ESCC 3.1 | |||
| ENSP, cycle 1 ESUTC, cycle 1 |
|||
| Caractéristiques sociodémographiques | Éducation | 15 à 79 ans | ESCC 3.1 |
| ENSP, cycle 6 | |||
| Revenu | 6 à 79 ans | ESCC 3.1 | |
| ENSP, cycle 6 | |||
| Population active | 15 à 75 ans | ESCC 3.1 | |
| ENSP, cycle 6 | |||
| Renseignements sociodémographiques | 6 à 79 ans | ESCC 3.1 | |
| Exposition au soleil | Exposition au soleil | 6 à 79 ans | ESCC 3.1 |
|
* Lorsqu’aucun titre d’enquête n’est indiqué, l’ECMS est la seule enquête permettant à Statistique Canada de recueillir ces données. Autrement, l’ECMS a utilisé le contenu tiré directement des enquêtes figurant dans le tableau ou un contenu similaire à celui de ces enquêtes. ESCC = Enquête sur la santé dans les collectivités canadiennes ENSP = Enquête nationale sur la santé de la population ELNEJ = Enquête longitudinale nationale sur les enfants et les jeunes ESUTC = Enquête de surveillance de l’usage du tabac au Canada |
|||
Thème |
Sujet |
Âge des répondants de l’ECMS |
|---|---|---|
Anthropométrie |
Circonférence des hanches |
6 à 79 ans |
Taille en position assise |
6 à 79 ans | |
Plis cutanés |
6 à 79 ans | |
Taille en position debout |
6 à 79 ans | |
Circonférence de la taille |
6 à 79 ans | |
Poids |
6 à 79 ans | |
Santé cardiovasculaire et condition physique |
Tension artérielle |
6 à 79 ans |
Fréquence cardiaque (au repos) |
6 à 79 ans | |
Physitest aérobie canadien modifié (PACm — exercice de l’escalier) |
6 à 69 ans | |
Fonction respiratoire |
Spirométrie |
6 à 79 ans |
Aptitudes musculosquelettiques |
Force de préhension |
6 à 79 ans |
Redressements assis partiels |
6 à 69 ans | |
Flexion du tronc |
6 à 69 ans | |
Santé bucco-dentaire |
Examen de santé bucco-dentaire |
6 à 79 ans |
Activité physique |
Accélérométrie (moniteur d'activité) |
6 à 79 ans |
Prélèvement d’échantillons |
Prélèvement d’échantillons de sang |
6 à 79 ans |
Entreposage des échantillons de sang et d’urine |
6 à 79 ans | |
Prélèvement d’échantillons d’urine |
6 à 79 ans |
| Thème | Sujet | Âge des répondants de l’ECMS |
|---|---|---|
| Sélection | Respect des lignes directrices | 6 à 79 ans |
| Condition physique et problèmes de santé | 6 à 79 ans | |
| Aptitude à l’activité physique (PAR) | 6 à 79 ans | |
| Confirmation d’autres substances | 14 à 79 ans | |
| Fonction respiratoire | Questions relatives à la spirométrie | 6 à 79 ans |
| Restrictions relatives à la spirométrie | 6 à 79 ans | |
| Santé bucco-dentaire | Questions sur la santé bucco-dentaire | 6 à 79 ans |
| Restrictions concernant l’examen bucco‑dentaire | 6 à 79 ans | |
| Prélèvement d’échantillons | Questions relatives au prélèvement de sang | 6 à 79 ans |
| Thème | Sujet | Sang/ urine | Âge des répondants de l’ECMS | Laboratoire de référence |
|---|---|---|---|---|
| Santé cardiovasculaire | Apolipoprotéine A1 | S | 6 à 79 ans (s) (à jeun) | SC |
| Apolipoprotéine B | S | 6 à 79 ans (s) (à jeun) | SC | |
| Protéine C-réactive (haute sensibilité) | S | 6 à 79 ans | SC | |
| Fibrinogène | S | 12 à 79 | SC | |
| Lipoprotéines de haute densité (HDL) | S | 6 à 79 ans | SC | |
| Homocystéine | S | 6 à 79 ans | SC | |
| Lipoprotéines de basse densité (LDL) | S | 6 à 79 ans (s) (à jeun) |
SC | |
| Cholestérol total | S | 6 à 79 ans | SC | |
| Ratio cholestérol total-HDL | S | 6 à 79 ans | SC | |
| Triglycérides | S | 6 à 79 ans (s) (à jeun) | SC | |
| Batterie d’analyses chimiques | Alanine aminotransférase (ALT) | S | 6 à 79 ans | SC |
| Albumine | S | 6 à 79 ans | SC | |
| Phosphatase alcaline (ALP) | S | 6 à 79 ans | SC | |
| Aspartate aminotransférase (AST) | S | 6 à 79 ans | SC | |
| Bicarbonate (HCO3) | S | 6 à 79 ans | SC | |
| Calcium | S | 6 à 79 ans | SC | |
| Chlorure | S | 6 à 79 ans | SC | |
| Créatinine (voir le thème de la santé des reins) | ||||
| Gamma-glutamyl transférase (GGT) | S | 6 à 79 ans | SC | |
| Glucose (voir le thème du diabète) | ||||
| Lactate déshydrogénase (LD) | S | 6 à 79 ans | SC | |
| Phosphore | S | 6 à 79 ans | SC | |
| Potassium | S | 6 à 79 ans | SC | |
| Sodium | S | 6 à 79 ans | SC | |
| Bilirubine totale | S | 6 à 79 ans | SC | |
| Protéines totales | S | 6 à 79 ans | SC | |
| Urée (voir le thème de la santé des reins) | ||||
| Acide urique | S | 6 à 79 ans | SC | |
| Diabète | Glucose | S | 6 à 79 ans | SC |
| Hémoglobine glyquée (HbA1c) | S | 6 à 79 ans | SC | |
| Insuline | S | 6 à 79 ans (s) (à jeun) | SC | |
| Exposition aux contaminants environnementaux | Bisphénol A | U | 6 à 79 ans (s) | INSPQ |
| Cotinine | U | 6 à 79 ans | INSPQ | |
| Métaux : | ||||
| Antimoine | U | 6 à 79 ans | INSPQ | |
| Arsenic (total) | S&U | 6 à 79 ans | INSPQ | |
| Cadmium | S&U | 6 à 79 ans | INSPQ | |
| Cuivre | S&U | 6 à 79 ans | INSPQ | |
| Plomb | S&U | 6 à 79 ans | INSPQ | |
| Manganèse | S&U | 6 à 79 ans | INSPQ | |
| Mercure (total) | S | 6 à 79 ans | INSPQ | |
| Mercure inorganique | S | 6 à 79 ans (s) | INSPQ | |
| Mercure inorganique | U | 6 à 79 ans | INSPQ | |
| Molybdène | S&U | 6 à 79 ans | INSPQ | |
| Nickel | S&U | 6 à 79 ans | INSPQ | |
| Sélénium | S&U | 6 à 79 ans | INSPQ | |
| Uranium | S&U | 6 à 79 ans | INSPQ | |
| Vanadium | U | 6 à 79 ans | INSPQ | |
| Zinc | S&U | 6 à 79 ans | INSPQ | |
| Pesticides organochlorés | S | 20 à 79 ans (s) (à jeun) | INSPQ | |
| Pesticides organophosphatés | U | 6 à 79 ans (s) | INSPQ | |
| biphényles polychlorés (BPC) | S | 20 à 79 ans (s) (à jeun) | INSPQ | |
| Composés perfluorés (PFHxS, PFOS, PFOA) | S | 20 à 79 ans (s) | INSPQ | |
| Herbicides du type phénoxy (2,4-D, 2, 4 DCP) | U | 6 à 79 ans (s) | INSPQ | |
| Biphényles polybromés (PBB) | S | 20 à 79 ans (s) (à jeun) | INSPQ | |
| Éthers diphényliques polybromés (PBDE) | S | 20 à 79 ans (s) (à jeun) | INSPQ | |
| métabolites de phtalates | U | 6 à 49 ans | INSPQ | |
| Pesticides pyréthroïdes | U | 6 à 79 ans | INSPQ | |
| Général | Hémogramme | |||
| Plaquettes | S | 6 à 79 ans | CEM | |
| Numération érythrocytaire : | S | 6 à 79 ans | CEM | |
| Hématocrite | S | 6 à 79 ans | CEM | |
| Hémoglobine | S | 6 à 79 ans | CEM | |
| Teneur corpusculaire moyenne en hémoglobine (TCMH) | S | 6 à 79 ans | CEM | |
| Concentration corpusculaire moyenne en hémoglobine (CCHM) | S | 6 à 79 ans | CEM | |
| Volume globulaire moyen (VGM) | S | 6 à 79 ans | CEM | |
| Indice de distribution des globules rouges (IDGR) | S | 6 à 79 ans | CEM | |
| Numération des globules blancs : | S | 6 à 79 ans | CEM | |
| Basophiles | S | 6 à 79 ans | CEM | |
| Eosinophiles | S | 6 à 79 ans | CEM | |
| Lymphocytes | S | 6 à 79 ans | CEM | |
| Monocytes | S | 6 à 79 ans | CEM | |
| Neutrophiles | S | 6 à 79 ans | CEM | |
| Marqueurs de maladies infectieuses | Hépatite A (anti-VHA) | S | 14 à 79 ans | LNM |
| Hépatite B (anti-HBs et anti-HBc) | S | 14 à 79 ans | LNM | |
| Hépatite B (AgHBs; anti‑HBc positif seulement) | S | 14 à 79 ans (s) | LNM | |
| Hépatite C (anti-VHC) | S | 14 à 79 ans | LNM | |
| Santé des reins | Créatinine | S et U | 6 à 79 ans | SC pour les analyses de sang /INSPQ pour les analyses d’urine |
| Microalbumine | U | 6 à 79 ans | SC | |
| Ratio microalbumine-créatinine | U | 6 à 79 ans | SC | |
| Urée | S | 6 à 79 ans | SC | |
| État nutritionnel | ||||
| Folate dans les globules rouges | S | 6 à 79 ans | SC | |
| Iode | U | 6 à 79 ans | SC | |
| Ratio iode-créatinine | U | 6 à 79 ans | SC | |
| Vitamine B12 | S | 6 à 79 ans | SC | |
| Vitamine D | S | 6 à 79 ans | SC | |
| (s) = sous-groupe (certains tests de laboratoire sont effectués uniquement pour un sous‑groupe aléatoire de la fourchette d’âge indiquée) SC = Santé Canada INSPQ = Institut national de santé publique du Québec CEM = Centre d’examen mobile LNM = Laboratoire national de microbiologie de l’Agence de la santé publique du Canada |
||||
5. Plan d’échantillonnage
5.1 Population cible
L’Enquête canadienne sur les mesures de la santé (ECMS) vise la population âgée de 6 à 79 ans vivant à domicile et résidant dans les 10 provinces et trois territoires. Sont exclues du champ de l’enquête les personnes qui vivent dans les réserves et dans d’autres établissements autochtones des provinces, les pensionnaires des établissements et les membres à temps plein des Forces canadiennes. Les personnes vivant dans certaines régions éloignées ainsi que les personnes vivant dans des régions où la densité de population est faible ont été exclues. L’ECMS couvre environ 96,3 % de la population canadienne âgée de 6 à 79 ans.
5.2 Taille et répartition de l’échantillon
Afin de produire des estimations fiables au niveau national par groupe d’âge et par sexe, cette l’enquête doit être réalisée auprès d’un échantillon minimum de 5 000 personnes sur une période de 2 ans. L’échantillon doit comporter au minimum 500 personnes par sexe pour chacun des cinq groupes d’âge suivants : 6 à 11 ans, 12 à 19 ans, 20 à 39 ans, 40 à 59 ans et 60 à 79 ans.
5.3 Bases de sondage et stratégie d’échantillonnage
Pour répondre aux exigences de l’ECMS, une stratégie d’échantillonnage à plusieurs degrés a été utilisée.
5.3.1 Échantillonnage des sites de collecte
Comme les participants à l’ECMS doivent se présenter à un centre d’examen mobile (CEM), ils doivent pouvoir s’y rendre en un temps raisonnable. La base de sondage de l’Enquête sur la population active (EPA) a été utilisée pour créer les sites de collecte et contrôler leur taille afin de répondre à ces exigences. À partir des grappes de la base de sondage de l’EPA, on a créé 257 sites de collecte. Les grappes sont de petites unités géographiques qui contiennent environ 200 logements. Un site de collecte est une région géographique comptant au moins 10 000 habitants, définie de façon telle que la distance que doivent parcourir les participants à l’enquête n’excède pas 50 kilomètres dans les régions urbaines et 100 kilomètres dans les régions rurales. Les régions ne répondant pas à ces critères ont été exclues. Les sites couvrent 96,3 % de la population canadienne âgée de 6 à 79 ans.
Bien que seules des estimations nationales étaient nécessaires, les sites de collecte ont été stratifiés en cinq régions pour s’assurer que la répartition de l’échantillon soit représentative de la population nationale. Les cinq régions correspondent aux limites régionales types de Statistique Canada, à savoir la Colombie-Britannique, les Prairies (Alberta, Manitoba et Saskatchewan), l’Ontario, le Québec et les provinces de l’Atlantique (Terre-Neuve-et-Labrador, Île-du-Prince-Édouard, Nouvelle-Écosse et Nouveau-Brunswick).
Un grand nombre de sites de collecte comptant un petit nombre de participants est recommandé pour optimiser la précision des estimations. Toutefois, compte tenu des contraintes logistiques et budgétaires inhérentes à l’utilisation du CEM, le nombre de sites de collecte a été limité à 15. On a réparti les 15 sites de collecte entre les régions proportionnellement à la taille de la population (tableau 5.1).
Région |
Population cible estimée, de 6 à 79 ans, Recensement de 2001 | Nombre de sites dans la région | Nombre de sites répartis |
|---|---|---|---|
Atlantique |
2 061 425 | 36 | 1 |
Québec |
6 560 375 | 50 | 4 |
Ontario |
10 248 545 | 61 | 6 |
Prairies |
4 538 970 | 77 | 2 |
Colombie-Britannique |
3 540 000 | 33 | 2 |
Total |
26 949 315 | 257 | 15 |
Dans chaque région, les sites de collecte ont été triés en fonction de leur appartenance à une région métropolitaine de recensement (RMR), puis en fonction de la taille de la population avant la sélection. Une RMR est une région constituée d’une ou de plusieurs municipalités contiguës entourant une grande région urbaine (appelée noyau urbain). Le noyau urbain doit compter au moins 100 000 habitants pour former une RMR. Les sites de collecte ont ensuite été échantillonnés systématiquement avec une probabilité de sélection proportionnelle à la taille de leur population. Cette méthode de sélection, conjuguée au tri des sites selon l’appartenance ou non à une RMR et selon la taille de la population, a permis de s’assurer que les sites sélectionnés soient répartis entre les RMR et les non-RMR, ainsi qu’entre les régions très peuplées et peu peuplées. Bien qu’il n’y en ait pas dans toutes les provinces et tous les territoires, les sites de collecte des données de l’ECMS ont été choisis de manière qu’ils soient représentatifs de la population canadienne, d’est en ouest, compte tenu des grandes et et des faibles densités de population.
La collecte des données aux 15 sites s’est effectuée séquentiellement au cours de deux années. Les sites ont été classés de façon à tenir compte de la saisonnalité selon la région et de l’effet temporel, sous réserve des contraintes opérationnelles et logistiques. Par effet temporel, on entend que le nombre de sites par région est réparti uniformément entre la première et la deuxième année (à l’exception de la région de l’Atlantique où il n’y a qu’un seul site).
5.3.2 Échantillonnage des logements
Plusieurs options ont été étudiées afin de décider du meilleur moyen d’obtenir le nombre requis de participants par groupe d’âge. Celle qui a été retenue utilise le Recensement de 2006 comme base de sondage. La composition des ménages occupant les logements en mai 2006 était connue et pouvait être utilisée pour établir un plan de sondage satisfaisant les exigences d’échantillonnage dans chaque groupe d’âge.
Dans chaque site de collecte, les logements dont on connaissait la composition du ménage au moment du Recensement de 2006 ont été stratifiés selon l’âge des occupants au moment de l’enquête. Cinq strates selon le groupe d’âge, qui correspondent aux cinq groupes d’âge de l’ECMS (6 à 11 ans, 12 à 19 ans, 20 à 39 ans, 40 à 59 ans et 60 à 79 ans), ont été créées. L’âge a été déterminé en se basant sur la date du début de la collecte des données à chaque site.
- Strate 6 à 11 ans : logements où au moins un enfant de 6 à 11 ans est présent, sinon,
- Strate 12 à19 ans : logements où au moins un jeune de 12 à 19 ans est présent, sinon,
- Strate 60 à 79 ans : logements où au moins une personne de 60 à 79 ans est présente, sinon,
- Strate 20à 39 ans : logements où au moins une personne de 20 à 39 ans est présente, sinon,
- Strate 40 à 59 ans : logements où au moins une personne de 40 à 59 ans est présente, sinon,
- Strate « autre » : logements non compris dans les strates susmentionnées, comme les logements inoccupés au moment du Recensement de 2006 ou ceux habités par des personnes en dehors de la tranche d’âge visée par l’ECMS d’après la composition du ménage au moment du Recensement de 2006.
Chaque strate a une forte probabilité de contenir des logements habités par des personnes appartenant aux groupes d’âge souhaités, qu’elles soient les mêmes occupants ou qu’elles soient remplacées par un ménage semblable. À chaque site, un échantillon aléatoire simple de logements est sélectionné dans chaque strate. La taille d’échantillon est répartie dans chaque strate de sorte que, en combinaison avec la stratégie d’échantillonnage des répondants à l’enquête, un nombre égal de répondants par groupe d’âge puisse être obtenu. On prend contact avec chaque logement sélectionné afin de dresser la liste courante des membres du ménage, que l’on utilise ensuite pour sélectionner les répondants à l’enquête. Pour couvrir les nouveaux logements construits depuis le recensement ou les logements manqués lors du recensement et réduire le sous-dénombrement, des logements provenant du Registre des adresses ont également été échantillonnés.
Le tableau 5.2 donne une distribution du nombre de logements sélectionnés par site. Au total, 9 349 logements ont été sélectionnés, soit une moyenne de 623 logements par site.
| Site | Nombre de logements |
|---|---|
| 1 | 590 |
| 2 | 610 |
| 3 | 611 |
| 4 | 536 |
| 5 | 580 |
| 6 | 626 |
| 7 | 655 |
| 8 | 664 |
| 9 | 656 |
| 10 | 659 |
| 11 | 659 |
| 12 | 654 |
| 13 | 611 |
| 14 | 616 |
| 15 | 622 |
| Total | 9 349 |
5.3.2.1 Sous-échantillonnage des répondants à jeun
Chaque logement échantillonné a été étiqueté au hasard pour indiquer si un rendez-vous à la clinique devrait être offert le matin ou l’après-midi au répondant. Un rendez-vous le matin exigeait que le répondant jeûne pendant la nuit, alors que des restrictions alimentaires plus courtes étaient imposées aux répondants qui avaient un rendez-vous l’après-midi. Cette attribution aléatoire a réduit le biais potentiel, qui pourrait se produire si les répondants étaient en mesure de choisir l’heure de leur rendez-vous. Pendant la collecte, les taux d’échantillonnage ont été ajustés afin d’obtenir environ la moitié des répondants qui avaient été sélectionnés pour un rendez-vous à jeun et qui ont en effet jeûné.
5.3.2.2 Sous-échantillonnage de l’éther diphénylique polybromé (EDP)/des biphényles polychlorés (BPC)
Ce sous‑échantillon était en réalité un sous‑ensemble du sous‑échantillon de personnes à jeun. Cette mesure a été prise seulement chez les répondants âgés de 20 à 79 ans (au moment de l’interview à domicile).
5.3.2.3 Sous-échantillonnage du mercure inorganique
Chaque logement échantillonné a été désigné aléatoirement pour la prise d’une mesure du niveau de mercure inorganique chez le répondant. Durant la collecte, les fractions de sondage ont été rajustées de manière à permettre d’obtenir 500 personnes de sexe masculin et 500 personnes de sexe féminin âgées de 6 à 79 ans (au moment de l’interview à domicile). Dans les ménages où deux personnes ont été sélectionnées, l’une de 6 à 11 ans et l’autre de 12 à 79 ans, l’algorithme a été conçu de manière à sélectionner seulement une personne par ménage.
5.3.2.4 Sous-échantillonnage des composés perfluorés
Chaque logement échantillonné a été désigné aléatoirement pour la prise d’une mesure du niveau de composés perfluorés chez le répondant. Le but visé initialement était d’obtenir 250 répondants selon le sexe pour les trois groupes plus âgés (20 à 39 ans, 40 à 59 ans et 60 à 79 ans) pour un total de 1 500 répondants. À partir du site no 6, les exigences ont été modifiées de manière à inclure tous les répondants de 20 à 79 ans (au moment de l’interview à domicile). Toutefois, il a été impossible d’analyser cette composante dans les restes de sang des personnes non sélectionnées pour les cinq premiers sites. Par conséquent, il a été nécessaire de procéder à une pondération pour tenir compte du sous‑échantillon des cinq premiers sites.
5.3.2.5 Sous-échantillonnage des phtalates
Chaque logement échantillonné a été désigné aléatoirement pour la prise d’une mesure du niveau des phtalates chez le répondant. Tous les jeunes de 6 à 19 ans (au moment de l’interview du ménage) devaient être sélectionnés pour cette mesure. Les adultes de 20 à 49 ans devaient être sélectionnés s’ils faisaient partie d’un ménage où une seule personne était sélectionnée (pas de 6 à 11 ans dans le ménage). Le nombre total désiré de répondants était de 3 000 environ. Veuillez remarquer que les adultes de 50 ans et plus ont été exclus pour cette mesure.
5.3.3 Échantillonnage des personnes
Dans chaque strate, des probabilités de sélection différentes selon le groupe d’âge ont été appliquées afin de s’assurer d’atteindre les cibles d’échantillonnage (voir le tableau 5.3). On a communiqué avec les logements sélectionnés afin d’obtenir la liste courante des membres des ménages. Dans chaque logement, une ou deux personnes ont été sélectionnées selon la composition du ménage. Étant donné que les enfants doivent être accompagnés au CEM, deux personnes ont été sélectionnées dans les ménages comptant des enfants de 6 à 11 ans, à savoir un enfant choisi au hasard parmi les membres du ménage âgés de 6 à 11 ans et une deuxième personne choisie parmi les membres âgés de 12 à 79 ans. Si aucun enfant de 6 à 11 ans ne vivait dans le ménage, une seule personne était sélectionnée parmi les membres âgés de 12 à 79 ans. Le vecteur des poids pour la sélection des personnes de 12 à 79 ans a été construit de façon à éviter des poids d’échantillonnage individuels élevés. Puisque le poids pour certains groupes d’âge est jusqu’à cinq fois plus grand que pour d’autres, il est possible que le poids d’échantillonnage d’une personne sélectionnée soit très élevé si les membres du ménage sont nombreux dans un logement. Par conséquent, lorsqu’un nombre minimum spécifié de personnes de 12 à 79 ans vivent dans un ménage, le poids appliqué à chacune est ramené à 1. Le cas échéant, tous les membres du ménage ont une chance égale d’être sélectionnés. Diverses études et simulations ont permis d’établir un juste équilibre entre les paramètres requis pour chacune des mesures mises en place.
| Strate1 | Groupe d’âge | ||||
|---|---|---|---|---|---|
6 à 11 ans |
12 à 19 ans2 |
20 à 39 ans |
40 à 59 ans |
60 à 79 ans |
|
strate 6 à 11 ans |
1 | 5 | 1 | 1 | 1 |
strate 12 à 19 ans |
1 | 5 | 1 | 1 | 1 |
strate 60 à 79 ans |
1 | 1 | 1 | 1 | 2 |
strate 20 à 39 ans |
1 | 1 | 2 | 1 | 1 |
strate 40 à 59 ans |
1 | 1 | 1 | 2 | 1 |
strate « autre » |
1 | 5 | 1 | 1 | 1 |
5.3.3.1 Sous-échantillonnage des moniteurs d’activité
Un sous‑échantillon de répondants âgés de 6 à 79 ans, dont le moniteur d’activité comportait au moins quatre jours de données valides, a été créé.
5.3.3.2 Sous-échantillonnage du tabac
Un sous‑échantillon de 2 500 participants à la clinique âgés de 12 à 79 ans a été sélectionné au hasard pour le sous‑échantillon de la nicotine, du NNAL et des métabolites. L’échantillon a été réparti par groupe d’âge (12 à 19 ans, 20 à 39 ans, 40 à 59 ans et 60 à 79 ans) et par état quant au tabagisme dérivé des réponses des répondants au questionnaire des ménages (fumeur, non‑fumeur exposé à la fumée et non‑fumeur non exposé à la fumée). L’échantillon a été sélectionné parmi les personnes qui ont fourni un échantillon d’urine et ont consenti à ce qu’il soit entreposé pour des études ultérieures sur la santé.
6. Collecte des données
6.1 Préparation en vue de la collecte
6.1.1 Équipe de l’Enquête canadienne sur les mesures de la santé (ECMS)
L’équipe de l’ECMS est un groupe diversifié de personnes bien formées et expérimentées. Le groupe peut‑être subdivisé en trois sous‑groupes : équipe sur le terrain, équipe du centre d’examen mobile (CEM) et personnel du bureau central. Chacun de ces trois sous‑groupes était responsable de parties déterminées de l’enquête.
6.1.1.1 Équipe sur le terrainL’équipe sur le terrain de l’ECMS était constituée d’intervieweurs de la composante des ménages de Statistique Canada et d’un gestionnaire des intervieweurs. Les intervieweurs de la composante des ménages étaient principalement responsables de communiquer avec les ménages choisis, de mener les interviews auprès d’eux, d’expliquer la partie clinique de l’enquête aux répondants et de tenter de les inciter à se rendre au CEM. Les intervieweurs de l’ECMS étaient supervisés par un gestionnaire des intervieweurs qui était responsable de la tenue des activités d’assurance de la qualité des données pour la composante des ménages, de la supervision du suivi de la non‑réponse et du contrôle des taux de collecte auprès des ménages.
6.1.1.2 Équipe du centre d’examen mobile (CEM)L’équipe du CEM de l’ECMS était constituée de professionnels de la santé responsables des diverses composantes des tests destinées à obtenir des mesures physiques et d’un gestionnaire de site chargé de superviser les activités au jour le jour du CEM. Les spécialistes des mesures de la santé étaient chargés de la majorité des tests visant à obtenir des mesures physiques des répondants (p. ex. tension artérielle, anthropométrie, condition physique, spirométrie). Les phlébotomistes/ technologues de laboratoire ont recueilli les échantillons (sang et urine), ont procédé à l’hémogramme et ont traité les échantillons biologiques en vue de leur entreposage et de leur expédition aux laboratoires de référence. Un dentiste autorisé a effectué les examens bucco‑dentaires. Outre les professionnels de la santé, l’équipe du CEM comprenait aussi du personnel administratif travaillant à la réception, au bureau des rendez‑vous et comme assistants dentaires pour l’enregistrement des données pendant la composante de la santé bucco‑dentaire, ainsi qu’un agent de la logistique du site chargé de l’entretien des remorques.
6.1.1.3 Personnel du bureau centralLe personnel de l’ECMS au bureau central a contrôlé les taux de réponse et la qualité des données recueillies et, grâce à des visites périodiques des sites, le rendement du personnel. Ces employés ont assuré le soutien des ressources humaines, ont traité les données et ont évalué les résultats des laboratoires de référence. En outre, le personnel du bureau central a rédigé et a envoyé par la poste aux répondants les rapports de certains tests de laboratoire et a fourni des renseignements concernant l’enquête aux répondants, au grand public et aux médias. Enfin, un conseiller médical a assuré le suivi auprès des répondants concernant les résultats de nature délicate ou d’importance capitale.
6.1.2 Centre d’examen mobile (CEM)
Deux ensembles de remorques ont été acquis, afin de procéder aux composantes des mesures physiques et de laboratoire de l’ECMS. Chaque CEM était constitué de deux remorques, une servant de section d’administration et l’autre, de clinique. Les remorques comportaient différentes salles, y compris une réception, des toilettes, un bureau administratif, une salle d’évaluation de la condition physique, une salle de sélection, une salle d’examen bucco-dentaire, des salles réservées à l’anthropométrie et à la phlébotomie, et un laboratoire.
Le recours à des CEM a comporté plusieurs avantages par rapport à une clinique fixe (c.‑à‑d. une clinique installée dans un immeuble à bureaux ou dans un hôpital). Il a permis de disposer d’un environnement de collecte uniformisé (installation de l’équipement, taille des salles, etc.) conçu pour répondre aux politiques en matière de sécurité et de confidentialité de Statistique Canada et qui offrait la souplesse nécessaire pour que le CEM soit installé à proximité des résidences des répondants. Les CEM ont aussi permis une plus grande comparabilité avec la National Health and Nutrition Examination Survey (NHANES) aux États‑Unis, qui utilise aussi des CEM.
6.1.3 Environnement informatique
On a eu recours aux interviews assistées par ordinateur (IAO) pour obtenir les réponses des ménages et pour mener les composantes des mesures physiques et du laboratoire de l’ECMS. L’IAO a permis d’adapter les interviews à chaque répondant sur la base de ses caractéristiques individuelles et de ses réponses à l’enquête. Par exemple :
- Les questions qui ne s’appliquaient pas aux répondants étaient automatiquement sautées.
- Des mesures de contrôle visant à isoler les réponses incohérentes ou hors norme ont été appliquées automatiquement et des messages‑guides ont été affichés à l’écran lorsqu’une entrée incorrecte était enregistrée. Le répondant a reçu une rétroaction immédiate et l’intervieweur a pu corriger toute incohérence.
- Le libellé des questions, y compris les périodes de référence et les pronoms, a été personnalisé automatiquement en fonction de facteurs comme l’âge et le sexe du répondant, la date de l’interview et les réponses aux questions précédentes.
Afin de permettre la saisie informatique des données dans le CEM, une architecture particulière de saisie des données a dû être élaborée, de façon à permettre à plus d’un utilisateur d’accéder au dossier d’un répondant depuis différentes salles du CEM. Cela a nécessité l’élaboration d’une application complexe et entièrement personnalisée de saisie des données utilisant des composantes de l’environnement des interviews téléphoniques assistées par ordinateur (ITAO).
Afin de limiter les erreurs dans l’entrée des données, d’accroître l’efficacité des activités de collecte des données et de réduire la nécessité d’entrer les données deux fois et de vérifier la saisie, le système de saisie des données au CEM a été conçu de façon à accepter les entrées directes à partir d’autre équipement de test électronique. On a notamment prévu des fonctions de communication (unidirectionnelle et bidirectionnelle) entre l’application et les appareils de mesure (p. ex. un appareil de mesure automatique de la tension artérielle, une balance). Dans les cas où l’entrée directe ne fonctionnait pas et qu’une entrée manuelle était requise, les données ont été entrées deux fois.
Afin d’appuyer la saisie électronique des données sur les mesures physiques et les besoins opérationnels et administratifs, le CEM a été équipé de son propre serveur. Après chaque séance au CEM, les données chiffrées ont été transmises par le serveur de la remorque, au moyen d’une ligne téléphonique de sortie réservée qui était reliée au bureau central de Statistique Canada. On a utilisé un logiciel de chiffrement pour assurer la confidentialité des données pendant la transmission entre le CEM et le bureau central.
6.1.4 Conception du questionnaire
6.1.4.1 Questionnaire auprès des ménagesLe contenu du questionnaire destiné aux ménages a été élaboré avec l’aide d’intervenants (de Santé Canada et de l’Agence de la santé publique) et d’experts externes, qui ont participé en tant que membres de divers comités consultatifs. Outre de nouvelles questions, des questions existantes sur la santé ont été tirées d’autres enquêtes (p. ex. l’Enquête sur la santé dans les collectivités canadiennes [ESCC]), en vue de l’élaboration du questionnaire de l’ECMS. Des groupes de discussion et des interviews individuelles ont été menés afin d’examiner certains aspects du contenu proposé du questionnaire. Des améliorations ont été apportées au libellé du questionnaire et aux instructions, ainsi qu’à l’enchaînement des questions, par suite de ces essais. Tout au long du processus d’essai du questionnaire, des experts internes et externes et des intervenants ont été consultés avant de mettre la dernière main aux changements de contenu.
6.1.4.2 Questionnaire de la partie cliniqueL’élaboration de la partie clinique de l’enquête s’est déroulée à peu près de la même façon que celle du questionnaire auprès des ménages. On a déterminé le contenu et plusieurs itérations de l’application de collecte ont été produites. Chaque itération a été évaluée afin de déterminer le meilleur enchaînement dans le CEM pour le répondant et le personnel du CEM, ainsi que la quantité et la qualité des données recueillies. Comme dans le cas du questionnaire auprès des ménages, on a fréquemment consulté des experts afin de veiller à ce que la partie clinique atteigne l’objectif de recueillir des résultats de grande qualité.
6.1.4.3 EssaiLe test ultime a pris la forme d’un essai à grande échelle, qui a été mené pour vérifier les modules concernant la santé générale, le sommeil, la taille et le poids, les problèmes de santé chroniques, la nutrition et les activités physiques et sédentaires. L’essai a fourni la première occasion d’examiner le contenu possible du questionnaire auprès des ménages et de celui de la partie clinique, en parallèle avec les tests visant à recueillir des mesures physiques. On a aussi mis à l’essai l’enchaînement des tests visant à recueillir des mesures physiques dans le CEM, ainsi que les questions de sélection et d’administration connexes.
6.2 Collecte
Les données du cycle 1 de l’Enquête canadienne sur les mesures de la santé (ECMS) ont été recueillies entre le 19 mars 2007 et le 25 février 2009, dans 15 sites de collecte au pays, de Moncton à Vancouver. Pendant qu’une paire de remorques était utilisée pour la collecte, la deuxième était acheminée au site suivant, et l’ensemble rigoureux de procédures nécessaires en vue de la collecte était entrepris.
6.2.1 Collecte — Interview auprès des ménages
Entre une et deux semaines avant le début des interviews auprès des ménages dans chaque site de collecte, une lettre et un dépliant ont été envoyés par la poste aux logements sélectionnés pour l’enquête, afin de les informer qu’ils seraient contactés pour participer à l’enquête. Les intervieweurs ont appelé chaque ménage ou se sont rendus sur place afin de prendre rendez‑vous pour une interview. Une fois le contact établi avec le ménage, l’intervieweur a présenté l’enquête en énonçant les étapes de base et en informant la personne que la participation était volontaire et que les renseignements fournis seraient gardés confidentiels en vertu de la Loi sur la statistique.
À partir des renseignements démographiques recueillis, une ou deux personnes du ménage ont été sélectionnées pour participer à l’enquête, à partir de différentes probabilités de sélection selon le groupe d’âge. L’algorithme de sélection a été conçu pour tenter d’obtenir une répartition égale des personnes entre les différents groupes d’âge. Si deux personnes étaient sélectionnées dans un ménage, l’une d’elles avait toujours entre 6 et 11 ans, et l’autre, entre 12 et 79 ans.
Avant le début de l’interview, on a informé les répondants au sujet de l’enquête et on leur a présenté une brève vidéo de présentation (quatre minutes). Dans le cas des répondants de 6 à 11 ans, un adulte était présent pendant l’interview pour répondre aux questions avec l’aide de l’enfant. Tous les répondants de 12 à 79 ans qui étaient capables de répondre aux questions par eux‑mêmes l’ont fait.
À la fin de l’interview, l’intervieweur a fourni au répondant une trousse d’information, en vue de lui expliquer la partie clinique de l’enquête, de l’informer au sujet des tests effectués au centre d’examen mobile (CEM) et de lui fournir des renseignements généraux au sujet de l’enquête. L’intervieweur a brièvement passé en revue les documents de la trousse d’information et a répondu aux questions. À ce moment‑là, l’intervieweur a informé le répondant qu’on lui avait donné un rendez‑vous le matin ou l’après‑midi/le soir au CEM. Dans le cas de la séance du matin, le répondant devait être à jeun depuis 12 heures pour la mesure de la glycémie à jeun, des lipides sanguins et des niveaux d’insuline, notamment. Voir l’annexe 1 pour une liste des lignes directrices à suivre avant les tests qui ont été fournies aux répondants pendant l’interview auprès des ménages.
Si le répondant était âgé de 14 ans ou plus, l’intervieweur lui a demandé de prendre rendez‑vous au CEM. Les parents ont dû prendre rendez‑vous pour leurs enfants de 6 à 13 ans. À la fin de chaque journée, les intervieweurs ont transmis tous les cas terminés à Statistique Canada.
6.2.2 Collecte — Centre d’examen mobile (CEM)
Les renseignements relatifs au répondant a été entré dans la base de données à la réception dès l’arrivée de celui-ci au CEM. Le personnel du CEM a vérifié si le nom, le sexe, la date de naissance et la langue officielle du répondant (données recueillies au moment de l’interview auprès du ménage) étaient exacts. On a vérifié si les lignes directrices à suivre avant les tests avaient été suivies et on a documenté le tout dans l’application de saisie du CEM.
Avant le début des tests visant à recueillir les mesures physiques, le répondant devait avoir consenti à participer à la partie clinique de l’enquête. Les parents ou tuteurs ont donné leur consentement au nom de leurs enfants de 6 à 13 ans, alors que ceux‑ci ont donné leur assentiment.
Après le module de consentement, le répondant (ou l’un des parents/tuteurs des répondants plus jeunes) a dû répondre à certaines questions de sélection à l’aide du Q-AAP (voir l’annexe 3). Bien que le Q-AAP ait été conçu pour les personnes âgées de 15 à 69 ans, il a été utilisé pour tous les répondants. Les parents ou tuteurs ont répondu aux questions de sélection au nom de leurs enfants de 6 à 13 ans. Certains répondants ont été exclus de certains tests de laboratoire ou mesures (voir l’annexe 2 — Critères d’exclusion, et l’annexe 3 — Q-AAP) selon leur âge, les réponses aux questions de sélection et le fait qu’ils étaient à jeun ou non.
Le répondant s’est par la suite rendu au CEM et a participé à tous les tests de laboratoire ou mesures auxquels il était admissible. Le répondant pouvait en tout temps refuser de participer à une mesure ou à un test. L’ordre des mesures et des tests sanguins a été établi de façon à ce que les effets d’une certaine mesure (p. ex. l’augmentation de la tension artérielle par suite du PACm) n’affectent pas les résultats d’une autre mesure (p. ex. la tension artérielle). Pour des renseignements détaillés concernant les protocoles suivis pour toutes les mesures, voir l’annexe 4.
Les échantillons de sang et d’urine recueillis auprès de chaque répondant ont été traités, ont fait l’objet d’un hémogramme (numération de la formule sanguine) et ont été entreposés temporairement dans des réfrigérateurs et des congélateurs du laboratoire du CEM. Les échantillons entreposés ont été acheminés chaque semaine aux laboratoires de référence, à Ottawa, à Québec et à Winnipeg, aux fins d’analyses supplémentaires liées à l’état de santé général, au diabète, aux maladies du rein, aux maladies cardiovasculaires, aux contaminants environnementaux et aux maladies infectieuses, et de leur entreposage dans le biobanque de l’ECMS. Les échantillons d’acide désoxyribonucléique (ADN) ont été envoyés deux fois par semaine à Winnipeg en vue d’être traités, étant donné que leur intégrité se détériore rapidement avec le temps.
Avant de quitter le CEM, le répondant a reçu un rapport concernant ses mesures et parfois une ou plusieurs lettres à l’intention de son fournisseur de soins de santé, au besoin (certains résultats de tension artérielle et de santé bucco‑dentaire pouvaient nécessiter un suivi). Quelques mois après la visite au CEM, un rapport des tests de laboratoire comprenant la majorité des résultats des tests de sang et d’urine du répondant a été envoyé. À la fin du cycle 1, un rapport de spirométrie a aussi été envoyé aux répondants. Les répondants de 14 ans et plus ont reçu leurs rapports de laboratoire et de spirométrie, tandis que les parents des répondants âgés de 6 à 13 ans ont reçu les rapports de leurs enfants.
6.2.3 Collecte — Visite à domicile
Afin de maximiser les taux de réponse à l’ECMS, on a offert l’option de la visite à domicile aux répondants qui ne voulaient pas ou qui ne pouvaient pas se rendre au CEM, mais qui étaient d’accord pour qu’un certain nombre de mesures soient recueillies à leur domicile. On a effectué 22 visites à domicile au cours de l’ensemble de la période de collecte du cycle 1.
La visite à domicile a été effectuée par deux employés de l’ECMS au minimum (le plus souvent un spécialiste des mesures de la santé et un technologue de laboratoire), qui ont utilisé des questionnaires sur papier pour l’enregistrement des données. Il n’y avait pas de différences dans les procédures utilisées pour les mesures à domicile, mais il y avait des différences mineures dans l’équipement utilisé (p. ex. balance, stadiomètre), parce que l’ensemble de l’équipement pour les visites à domicile devait être portatif. Comme dans le cas de la visite au CEM, le répondant pouvait, à tout moment, refuser de participer à une mesure ou à un test de laboratoire. La visite à domicile a pris moins de temps parce que les composantes du PACm, de la flexion du tronc et des redressements assis partiels n’ont pas été effectuées. La composante de la santé bucco‑dentaire a été effectuée uniquement si un dentiste était disponible au moment de la visite à domicile. Une fois de retour au CEM, le spécialiste des mesures de la santé a entré les données de la visite à domicile dans l’application et les a codées comme une visite à domicile. Le spécialiste des mesures de la santé principal a alors vérifié l’entrée des données. Un rapport des mesures a été envoyé par la poste au répondant, quelques jours après la visite à domicile. Les répondants ont reçu un rapport des tests de laboratoire quelques mois plus tard et un rapport de leurs résultats de spirométrie à la fin du cycle 1.
6.3 Réduction de la non‑réponse
6.3.1 Réduction de la non‑réponse — Interview auprès des ménages
Afin d’obtenir le meilleur taux de réponse possible de la part des ménages, de nombreuses pratiques ont été utilisées pour réduire la non‑réponse.
6.3.1.1 Lettres de présentation et dépliantsAvant le début de chaque période de collecte, des lettres de présentation et des dépliants ont été envoyés aux ménages échantillonnés, en vue d’expliquer les différentes étapes de l’enquête et de souligner l’importance de l’enquête grâce à des exemples de la façon dont les données de l’ECMS seraient utilisées.
6.3.1.2 Établissement du contactLes intervieweurs ont eu pour instructions de faire toutes les tentatives raisonnables pour obtenir les interviews nécessaires. Lorsque le moment de la visite de l’intervieweur ne convenait pas, un rendez‑vous a été pris pour que l’intervieweur revienne à un moment plus approprié. S’il n’y avait personne à la maison au moment de la première visite, un avis indiquant que l’intervieweur de l’ECMS était venu a été laissé à la porte. De nombreuses visites en personne ont été effectuées à divers moments, différents jours, jusqu’à ce que les répondants potentiels soient à la maison et soient disponibles pour participer à l’interview. Si les intervieweurs n’ont pas réussi à contacter un membre du ménage, ils ont tenté d’obtenir un nom et un numéro de téléphone pour le logement à partir d’annuaires téléphoniques, auprès des voisins, des concierges et des bureaux de gestion/location, afin de pouvoir appeler le ménage plus tard pour prendre rendez‑vous pour une visite en personne.
6.3.1.3 Procédures de refus — Interview auprès des ménagesL’intervieweur a tenté de convaincre le répondant de l’importance et des avantages possibles de la participation à l’enquête. Les personnes qui ont refusé de participer à l’enquête ont été contactées une deuxième fois par un autre intervieweur qui, encore une fois, a souligné l’importance de l’enquête et de la participation des ménages.
6.3.1.4 Obstacles linguistiques — Interview auprès des ménagesLa lettre de présentation et le dépliant de l’ECMS étaient disponibles en anglais, en français, en punjabi et en chinois. Les répondants ont été interviewés dans la langue officielle de leur choix (anglais ou français). Pour supprimer les obstacles linguistiques aux interviews, l’équipe de l’ECMS a, dans la mesure du possible, recruté des intervieweurs ayant certaines compétences linguistiques autres que dans les deux langues officielles. Au besoin, des cas ont été transférés à un intervieweur ou à un interprète externe ayant les compétences linguistiques nécessaires pour que les questions/instructions puissent être traduites pour le répondant afin de mener l’interview. Lorsque l’on n’a pas pu trouver de personnes ayant les compétences linguistiques nécessaires, on a aussi accepté qu’un membre du ménage traduise pour le répondant, s’il était disposé à le faire et capable de le faire. À noter que cela n’est pas considéré comme une interview par procuration. Le membre du ménage traduisait simplement les questions et les réponses du répondant directement à l’intention de l’intervieweur, sans répondre pour le répondant.
6.3.1.5 Jeunes répondants — Interview auprès des ménagesLes intervieweurs ont dû obtenir la permission verbale des parents/tuteurs pour interviewer les jeunes de 12 à 17 ans qui ont été sélectionnés pour l’enquête. Plusieurs mesures ont été prises pour atténuer les préoccupations possibles des parents et faire en sorte que l’interview soit menée jusqu’au bout. Les intervieweurs ont fourni aux parents ou aux tuteurs une copie de la « Note à l’intention des parents et des tuteurs concernant l’interview auprès de jeunes dans le cadre de l’Enquête canadienne sur les mesures de la santé ». Ce document visait à expliquer l’objectif de la collecte de données auprès des jeunes, comportait une liste des sujets compris dans l’enquête et expliquait la nécessité de respecter le droit de l’enfant à la protection de ses renseignements personnels et à la confidentialité.
Lorsqu’ils ont interviewé des répondants de 12 à 17 ans, les intervieweurs ont veillé à ce que le parent soit à la maison, mais à ce que l’interview soit menée en privé, à moins que le jeune ait autorisé la présence du parent. Si l’intervieweur n’a pas pu interviewer le jeune sélectionné en privé, il a lu les questions à haute voix en présence du parent et a demandé au jeune d’entrer ses réponses directement à l’ordinateur. Si les exigences en matière de confidentialité et de protection des renseignements personnels n’ont pu être respectées, le cas a été codé comme un refus et une note permanente a été inscrite pour indiquer que la protection des renseignements personnels/confidentialité n’avait pu être assurée.
Si les parents ont demandé à en savoir davantage au sujet du type de questions posées dans l’enquête, les intervieweurs leur ont d’abord demandé de consulter la liste figurant dans la note aux parents. Dans les cas où ils ont demandé à voir les questions proprement dites, les intervieweurs leur ont montré la section du contenu du Manuel de l’intervieweur. Dans le cas des parents qui ont demandé une copie des questions, ils ont pu l’obtenir par l’entremise du gestionnaire de la collecte des données ainsi qu’au bureau central de Statistique Canada à Ottawa.
6.3.1.6 Interviews par procurationDans le cadre de l’ECMS, les parents/tuteurs ont répondu à des questions concernant leurs enfants de 6 à 11 ans. Cela comprenait tous les modules du questionnaire auprès des ménages s’appliquant aux enfants. Les enfants ont aidé à répondre à certaines questions pour lesquelles les parents ne connaissaient pas la réponse (p. ex. la participation à des activités pendant les heures de classe).
Dans les cas où les répondants de 12 ans et plus sélectionnés étaient, pour des raisons de santé physique ou mentale, incapables de subir l’interview auprès des ménages, les renseignements à leur sujet ont été fournis par un autre membre bien informé du ménage. Même si ces répondants par procuration étaient en mesure de donner des réponses exactes à la plupart des questions de l’enquête, les questions de nature délicate ou personnelle dépassaient le cadre de leurs connaissances. Par conséquent, certaines questions posées dans le cadre des interviews par procuration sont demeurées sans réponse. On s’est donc efforcé par tous les moyens de réduire au minimum le nombre d’interviews de ce genre. La variable « PROXY » de l’ensemble de données indique si une interview auprès des ménages a été menée par procuration.
Au cours du cycle 1, 20 % des interviews ont été menées par procuration. Parmi ces interviews, 97 % touchaient des répondants de moins de 12 ans et 3 %, des répondants de 12 ans et plus.
6.3.2 Réduction de la non‑réponse — Centre d’examen mobile (CEM)
Environ 85 % des répondants qui ont participé à l’interview auprès des ménages du cycle 1 ont accepté de se rendre au CEM. De nombreuses pratiques ont été utilisées pour obtenir ce niveau élevé de participation, y compris les suivantes :
6.3.2.1 Suivi de la non‑réponseLe personnel du CEM était chargé d’assurer un suivi auprès des répondants qui n’avaient pas pris rendez‑vous à la fin de leur interview. Il a aussi communiqué avec les répondants qui n’avaient pas appelé le centre de rendez‑vous du CEM pour fixer un rendez‑vous quelques jours après leur interview Les employés ont suivi les mêmes procédures de refus que celles des intervieweurs des ménages.
6.3.2.2 Souplesse de l’horaire du CEMParmi les stratégies propres au CEM figurait l’établissement des heures d’ouverture et de rendez‑vous du CEM en vue de fournir le maximum de souplesse aux répondants. Le personnel du CEM a tenté d’accueillir le plus grand nombre possible de répondants à chaque site. En outre, on a offert aux répondants qui ne souhaitaient pas se rendre au CEM ou qui n’étaient pas capables de le faire de les visiter à domicile.
6.3.2.3 Procédures de refus — CEMAfin de réduire la non‑réponse à l’ECMS, les employés du CEM ont dû prendre toutes les mesures raisonnables nécessaires pour convaincre les répondants qui ont participé à l’interview auprès des ménages de se rendre au CEM. Le personnel du centre de rendez‑vous, qui avait reçu une formation particulière pour la conversion des cas de refus, a assuré un suivi auprès des répondants qui ont refusé de participer à la partie clinique de l’enquête. S’ils ne réussissaient pas à fixer un rendez‑vous, le gestionnaire de site du CEM devait appeler une dernière fois pour tenter de fixer un rendez‑vous. Les répondants qui n’ont pu être contactés (p. ex. aucune réponse au numéro de téléphone du domicile) ont reçu une « Lettre de non‑contact » leur demandant d’appeler le CEM pour fixer un rendez‑vous.
6.3.2.4 Obstacles linguistiques — CEMLe personnel du CEM a traité les obstacles linguistiques de la même façon que les intervieweurs des ménages. Le personnel de l’ECMS et des interprètes externes ou des membres de la famille connaissant la troisième langue ont été mis à contribution pour aider les répondants comprendre les instructions et les formulaires, afin qu’ils puissent terminer leur visite au CEM. Les formulaires de consentement et les questions de sélection étaient aussi disponibles en chinois et en punjabi afin d’aider les répondants de ces groupes ethniques minoritaires, étant donné qu’on savait qu’un pourcentage élevé d’entre eux vivaient dans certaines zones de collecte de l’échantillon du cycle 1.
6.3.2.5 Jeunes répondants — CEMComme dans le cas des interviews auprès des ménages, les parents/tuteurs ont répondu à toutes les questions concernant leurs enfants de 6 à 11 ans. Les questions posées au CEM avaient trait à la sélection, à la santé pulmonaire et à la santé bucco‑dentaire. Étant donné que l’âge de consentement à la partie clinique de l’ECMS avait été fixé à 14 ans, les parents/tuteurs ont aussi répondu aux questions pour leurs jeunes de 12 et 13 ans, même si ceux‑ci ont généralement contribué à répondre. Les jeunes de 14 ans et plus devaient signer leur propre formulaire de consentement et répondre à toutes les questions, même si les parents/tuteurs étaient dans certains cas présents au moment de leur visite au CEM et pouvaient les aider pour les questions difficiles, au besoin. Afin de maximiser l’efficacité au CEM, l’enfant ou le jeune sélectionné a habituellement effectué les tests servant à recueillir les mesures physiques avec un employé de l’ECMS, tandis que le parent sélectionné effectuait les tests avec un autre employé de l’ECMS.
Dans les cas où le répondant sélectionné de 14 ans et plus était, pour des raisons de santé physique ou mentale, incapable de répondre aux questions et de remplir le formulaire de consentement au CEM, on a sollicité l’aide des parents/tuteurs.
6.4 Protocoles des mesures au centre d’examen mobile (CEM)
Pour des renseignements détaillés concernant les protocoles, voir l’annexe 4. Pour des renseignements détaillés sur les critères d’exclusion des tests, voir l’annexe 2.
6.4.1 Anthropométrie
La composante anthropométrique comprend la mesure de la taille (y compris la taille en position debout et en position assise) et du poids, la circonférence de la taille et la circonférence des hanches, ainsi que la mesure des plis cutanés. Au total, six mesures anthropométriques ont été recueillies auprès des répondants admissibles de 6 à 79 ans. Les problèmes de santé aigus ou chroniques ayant des répercussions particulières sur une ou plusieurs des mesures anthropométriques étaient une raison pour laquelle le répondant n’était pas admissible à l’une ou l’autre des mesures suivantes.
6.4.1.1 Taille en position deboutLa taille en position debout est une évaluation de la taille verticale maximale. Cette mesure a été prise pour tous les répondants capables de se tenir debout sans aide. La taille en position debout a été mesurée au moyen d’un stadiomètre fixe comportant une planche dorsale verticale et une équerre amovible, selon une procédure fondée sur la troisième édition du Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller CPHV) (troisième édition)3. On a utilisé la taille autodéclarée dans le cas des répondants qui n’étaient pas admissibles en raison d’un problème de santé aigu ou chronique (p. ex. ceux se déplaçant en fauteuil roulant) ou qui ont refusé que leur taille soit mesurée.
6.4.1.2 Taille en position assiseLa taille en position assise est une évaluation de la taille verticale maximale lorsque le répondant est assis. Elle a été mesurée pour les répondants capables de se tenir assis sans aide. La taille en position assise a été mesurée au moyen d’un stadiomètre fixe doté d’une planche dorsale verticale et d’une équerre amovible. La taille en position assise du répondant a été mesurée selon le protocole de l’International Society for the Advancement of Kinanthropometry (ISAK)4.
6.4.1.3 PoidsLe poids du répondant a été pris au moyen d’une balance numérique Mettler Toledo. Le poids du répondant a été mesuré suivant le protocole du Guide du conseiller CPHV (troisième édition)3.
6.4.1.4 Circonférence de la tailleLa circonférence de la taille donne un indice de l’accumulation abdominale de tissu adipeux. La circonférence de la taille du répondant a été mesurée selon le protocole du Guide du conseiller CPHV (troisième édition)3, un protocole qui a été modifié par la Société canadienne de physiologie de l’exercice à l’automne 2008. Nota : Dans le cadre de l’Enquête canadienne sur les mesures de la santé (ECMS), on a continué d’utiliser l’ancien protocole pour l’ensemble du cycle 1, et une étude transversale est menée pour permettre des comparaisons entre le cycle 1 et le cycle 2.
6.4.1.5 Circonférence des hanchesLa circonférence des hanches est la circonférence maximale mesurée aux hanches ou aux fesses (la plus grande de ces circonférences). Elle sert à calculer le rapport de la taille aux hanches (la circonférence de la taille divisée par la circonférence des hanches) et représente une méthode simple pour déterminer la répartition de la masse adipeuse. Le protocole de mesure de la circonférence des hanches est fondé sur la troisième édition du Physitest canadien normalisé5.
6.4.1.6 Plis cutanésLa mesure des plis cutanés sert à estimer l’adiposité générale et la répartition du tissu adipeux sous‑cutané. La technique repose sur le principe selon lequel la quantité de tissu adipeux sous‑cutané (tissu adipeux situé directement sous la peau) est proportionnelle à la quantité totale de tissu adipeux dans l’organisme. Les plis cutanés du répondant ont été mesurés selon la méthode en cinq points du protocole du Guide du conseiller 3. Les mesures des plis cutanés non pas été prises auprès des répondants dont l’indice de masse corporelle (IMS) était égal ou supérieur à 30 kg/m2.
6.4.2 Fréquence cardiaque et tension artérielle
La fréquence cardiaque et la tension artérielle (TA) au repos du répondant ont été mesurées, selon un nouveau protocole créé par l’ECMS et inspiré du rapport intitulé « Hypertension Surveillance in Canada: Minimum Standards For Assessing Blood Pressure In Surveys »6. Ce rapport a été publié par un comité d’experts constitué de membres de la Société canadienne d’hypertension artérielle, de la Coalition canadienne pour la prévention et le contrôle de l’hypertension artérielle et de la Fondation des maladies du cœur du Canada.
Des mesures de la fréquence cardiaque et de la tension artérielle ont été recueillies auprès de tous les répondants admissibles de 6 à 79 ans, au moyen d’un outil de mesure de la tension artérielle oscillométrique. Une série de mesures de la TA et de la fréquence cardiaque ont été recueillies à des intervalles d’une minute, après une période de repos de cinq minutes, et les cinq dernières mesures ont été utilisées pour déterminer la fréquence cardiaque et la tension artérielle moyennes au repos.
6.4.3 Spirométrie
Des mesures de spirométrie ont été recueillies auprès de tous les répondants admissibles de 6 à 79 ans, selon la mise à jour de 1994 de l’article « Standardization of Spirometry », publié par l’American Thoracic Society7. Parmi les raisons d’exclusion figuraient les crises cardiaques, les chirurgies à la poitrine ou à l’abdomen dans les trois mois, les chirurgies oculaires dans les six semaines, les médicaments contre la tuberculose, les grossesses de plus de 27 semaines et les problèmes de santé aigus ou chroniques.
6.4.4 Aptitudes musculosquelettiques
Des tests de condition physique ont été effectués pour tous les répondants admissibles de 6 à 69 ans, à l’exception du test de force de préhension qui a été effectué pour tous les répondants admissibles de 6 à 79 ans. La consommation de médicaments, les problèmes de santé aigus et chroniques, la grossesse et le non‑respect des lignes directrices à suivre avant les tests (voir l’annexe 1) étaient quelques raisons pour lesquelles un répondant pouvait ne pas être admissible à l’une ou l’autre des mesures. Les répondants âgés de 70 à 79 ans ont été exclus des tests de flexion du tronc, de redressements assis partiels et d’aptitude aérobie.
6.4.4.1 Composante de la force de préhensionPar force musculaire, on entend la force maximale qui peut être générée par un muscle ou un groupe de muscles particulier. La façon la plus courante de mesurer la force musculaire sur le terrain consiste à mesurer la force de préhension isométrique, grâce à un dynamomètre à poignée. Le protocole de la composante de la force de préhension a été fondé sur le Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller CPHV) (troisième édition)3.
6.4.4.2 Composante de la flexion du troncLe test de flexion du tronc est utilisé fréquemment sur le terrain pour évaluer la flexibilité du bas du dos et de l’articulation de la hanche. Le protocole de la composante de la flexion du tronc a été fondé sur le Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller CPHV)3.
6.4.4.3 Composante des redressements assis partielsLe test des redressements assis partiels évalue l’endurance des muscles abdominaux. Le protocole pour la composante des redressements assis partiels est fondé sur le Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller CPHV)3.
6.4.5 Composante du Physitest aérobie canadien modifié (PACm)
L’aptitude aérobie est une mesure de l’efficacité combinée des poumons, du cœur, du système sanguin et des muscles actifs à l’exercice. Le protocole de la composante du Physitest aérobie canadien modifié (PACm) est fondé sur le Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller CPHV) pour les adultes de 15 à 69 ans3, mais a été appliqué à tous les groupes d’âge.
6.4.6 Composante de la santé bucco-dentaire
Dans le cadre de la composante de la santé bucco‑dentaire, un dentiste a évalué l’état de santé bucco‑dentaire des répondants selon les critères de l’Organisation mondiale de la santé et été effectué pour tous les répondants admissibles de 6 à 79 ans. Les résultats de l’examen bucco‑dentaire ont été entrés directement à l’ordinateur, avec l’aide d’un assistant dentaire pour l’enregistrement des données. On a utilisé le système de numérotation de la Fédération dentaire internationale (FDI).
6.4.7Moniteur d'activité physique
Un moniteur d’activité physique Actical a été remis à tous les répondants admissibles de 6 à 79 ans, avec une ceinture ajustable, une enveloppe Xpresspost et une feuille de renseignements. On a exclu les répondants en fauteuil roulant.
6.5 Protocoles des mesures de laboratoire
6.5.1 Prélèvement d’échantillons
Des échantillons de sang et d’urine ont été prélevés afin d’obtenir des résultats de laboratoire qui permettent d’estimer la prévalence de la maladie et des facteurs de risque associés à certaines maladies, ainsi que de recueillir des données de base sur l’état de santé général de la population, l’état nutritionnel et les exposition aux contaminants environnementaux.
6.5.1.1 Prélèvement des échantillons de sang
Des échantillons de sang ont été prélevés par un phlébotomiste utilisant la technique de la vénipuncture uniformisée. La quantité de sang prélevé dépendait de l’âge des répondants :
- 6 à 11 ans : < 28 ml
- 12 à 13 ans : < 38 ml
- 14 à 19 ans : < 50 ml
- 20 à 79 ans : < 80 ml
On a augmenté la quantité de sang prélevé avec l’âge, le nombre de tests effectués étant plus élevé au fur et à mesure que le répondant avançait en âge. Par exemple, les répondants âgés de 6 à 11 ans ont fait moins de la moitié des tests faits par ceux âgés de 20 à 79 ans.
Les échantillons de sang sélectionnés pour l’ECMS ont été rangés par priorité. Il est donc important de mentionner qu’on a modifié l’ordre standard des prélèvements de sang afin de s’ajuster à la priorité des tests mesurés. L’ordre des tubes Vacutainer dépendait de la priorité du test par rapport à l’anticoagulant utilisé.
6.5.1.2 Prélèvement d’échantillons des échantillons d’urine
Des prélèvements d’échantillons d’urine ont été effectués au moyen de la technique en milieu de jet et on a demandé aux répondants de fournir environ 60 ml d’urine. Des prélèvements ont été effectués auprès de tous les répondants.
6.5.2 Analyse de l’hémogramme effectué au centre d’examen mobile (CEM)
L’hémogramme a été analysé au laboratoire du CEM par le technologue, et ce, pour tous les répondants ayant fourni un échantillon. Les résultats provenant des échantillons inappropriés (par exemple, hyperlipidémie ou caillot dans le tube) n’ont pas été déclarés.
6.5.3 Traitement et entreposage des échantillons de sang et d’urine
Il était important de traiter les échantillons aussi rapidement que possible, étant donné que la qualité et l’intégrité des échantillons de sang et d’urine se détériore au fil du temps. On a centrifugé le sang entier pour séparer le plasma des cellules et le sérum d’un caillot, afin de permettre la répartition des échantillons de sang dans des tubes plus petits. L’urine a aussi été répartie dans des tubes plus petits. Ces tubes ont été placés dans des plateaux d’expédition et entreposés au réfrigérateur ou au congélateur du laboratoire du CEM, selon l’analyse devant être exécutée. Tous les échantillons ont été entreposés dès que le traitement a pris fin, afin d’en assurer la viabilité.
6.5.4 Expédition
À l’exception des échantillons d’ADN qui étaient envoyé deux fois par semaine, l’expédition des aliquotes de sang et d’urine au laboratoire de référence avait lieu une fois par semaine selon des jours d’expédition fixés d’avance. Tous les colis ont été envoyés à l’un des trois laboratoires de référence : Santé Canada, à Ottawa, pour les résultats concernant les maladies chroniques, la santé générale (batterie d’analyses chimiques) et l’état nutritionnel; l’Institut national de santé publique du Québec (INSPQ), à Québec, pour les tests d’analyse des biomarqueurs environnementaux et de créatinine dans l’urine (ajustements environnementaux et santé des reins); et le Laboratoire national de microbiologie (LNM), à Winnipeg, pour les résultats relatifs aux maladies infectieuses et le biobanque de l’Enquête canadienne sur les mesures de la santé (ECMS). Les colis ont été emballés selon les règles de l’Association du transport aérien international (IATA) et celles relatives au transport des matières dangereuses (échantillons biologiques). Tous les colis ont été envoyés pour livraison le jour suivant par une entreprise de messagerie certifiée pour manipuler des matières dangereuses de façon à ce qu’ils arrivent seulement au laboratoire de référence en semaine. Un système de localisation a aussi été développé afin que le personnel puisse faire le suivi de chaque tube envoyé au laboratoire. De plus, la température des envois réfrigérés a fait l’objet d’un contrôle au moyen de dispositifs programmés au préalable qui prenaient la température toutes les 15 à 30 minutes pendant l’expédition. Cela a permis de s’assurer que les échantillons reçus par les laboratoires de référence avaient été maintenus à une température relativement constante pour préserver l’intégrité des échantillons pendant l’expédition.
Il est arrivé que les expéditions soient retardées et, une fois parvenues à destination, qu’on ait constaté que les conditions d’envoi ont été compromises. Tous les résultats des échantillons compromis ont été retirés pour s’assurer que seules les données de la plus grande qualité soient déclarées à l’ECMS par le laboratoire de référence.7. Traitement des données
7.1 Vérification
L’une des caractéristiques particulières de l’Enquête canadienne sur les mesures de la santé (ECMS) est que trois ensembles différents de données ont été recueillis auprès du même répondant : les données de l’interview auprès des ménages, les données des mesures cliniques et les données des résultats des analyses de laboratoire. Chaque ensemble de données a dû être traité individuellement, mais pas complètement à part des autres parce qu’à divers moments au cours du traitement, les trois ensembles de données devaient être utilisés ensemble.
Le traitement des données des interviews auprès des ménages a été exécuté de façon similaire à celui des autres enquêtes sur la santé de Statistique Canada. Les données ont d’abord été validées au niveau de l’enregistrement, puis au niveau de la variable individuelle, et la validation a été suivie par un contrôle détaillé descendant. Au cours de la collecte des données, le traitement a été assuré sur une base quotidienne (y compris les fins de semaine). Les réponses des interviews auprès des ménages ont dû être traitées rapidement, afin que les données soient disponibles au centre d’examen mobile (CEM) à temps pour la visite du répondant.
Parallèlement, le traitement des données sur les mesures cliniques a commencé par une validation des données au niveau de l’enregistrement, puis au niveau de la variable individuelle, suivie par un contrôle détaillé descendant. En outre, étant donné que les tests de laboratoire ont été déterminés en fonction des réponses à la partie clinique au CEM, les données cliniques ont été utilisées pour produire un fichier comprenant une liste des tests pour lesquels on s’attendait à recevoir des résultats. Ce fichier « de contrôle » du laboratoire a servi au traitement des données des résultats des analyses de laboratoire.
Le traitement des données des résultats des analyses de laboratoire a entraîné une manipulation importante de fichiers, étant donné que plusieurs types de fichiers différents ont été reçus du CEM et de trois laboratoires de référence. Puis, les données ont été validées au niveau de l’enregistrement et au niveau de la variable individuelle, et plusieurs nouvelles variables ont été dérivées. Les données de laboratoire ont été traitées le plus rapidement possible, afin que les résultats critiques déterminés par les laboratoires de référence et le CEM puissent être communiqués immédiatement aux répondants.
7.2 Questions pour lesquelles toutes les réponses appropriées doivent être choisies
Durant la première phase du processus de traitement des données, les questions pour lesquelles toutes les réponses appropriées doivent être choisies sont ventilées selon chaque catégorie de réponse dans la question initiale. Celle-ci devient alors une série de questions séparées pour lesquelles on donne la réponse oui ou non. Dans l'exemple ci-dessous, le répondant a donné les réponses 2 et 3 à la question initiale. Les réponses aux nouvelles questions sont basées sur les réponses à la question initiale.
Question initiale :
CCC_Q96 De quel type d’hépatite souffrez-vous ?
Intervieweur : Lisez les catégories au répondant. Choisissez toutes les réponses appropriées.
- Hépatite A
- X Hépatite B
- X Hépatite C
Questions/réponses finales :
CCC_96A De quel type d'hépatite souffrez-vous? - Hépatite A
- Oui
- X Non
- Ne sait pas, Non déclaré
CCC_96B De quel type d'hépatite souffrez-vous? - Hépatite B
- X Oui
- Non
- Ne sait pas, Non déclaré
CCC_96C De quel type d'hépatite souffrez-vous? - Hépatite C
- X Oui
- Non
- Ne sait pas, Non déclaré
7.3 Codage
Des catégories de réponses codées au préalable ont été fournies pour toutes les variables pertinentes, et les intervieweurs et les spécialistes des mesures de la santé ont été formés pour répartir les réponses des répondants entre les diverses catégories. Dans les cas où la réponse donnée par le répondant ne pouvait être assignée facilement à une catégorie existante, l’intervieweur pouvait, pour plusieurs questions, entrer une réponse en toutes lettres dans la catégorie « Autre – veuillez préciser ». Toutes ces questions ont fait l’objet d’un examen attentif au bureau central au moment du traitement. Dans le cas de certaines questions destinées aux ménages, les réponses en toutes lettres ont été codées selon l’une des catégories existantes dans la liste, si la réponse faisait double emploi. Autrement, la réponse a été codée comme « Autre ». En ce qui a trait aux réponses au questionnaire de la partie clinique, les réponses en toutes lettres ont été passées en revue et certaines ont été codées selon les catégories existantes à la fin du traitement. Pour ce qui est des autres réponses « Autre – veuillez préciser », certaines catégories ont été créées lorsqu’il y avait un nombre suffisant de réponses. Les réponses qui restaient ont été codées comme « Autre ». On tiendra compte des réponses « Autre – veuillez préciser » fournies pour toutes les questions lorsque l’on précisera les catégories de réponses en vue de futurs cycles de l’enquête.
Statistique Canada n’est pas autorisé à divulguer des noms de médicament et des marques de cigarette en particulier. Par conséquent, bien que ces renseignements soient recueillis, ils ne sont pas accessibles dans les fichiers principaux. Ces derniers comportent plutôt des variables codées qui représentent les renseignements relatifs à ces réponses (codes ATC et AHFS et teneurs en goudron (voir la section 12.6)).
Certaines données ont été recueillies sous forme de réponses en toutes lettres et on leur a attribué des codes, plus particulièrement les noms et la posologie des médicaments et des autres produits de santé, les noms des marques de cigarettes et les données de descriptions d’emplois. Dans le cas des noms de médicaments et de cigarettes, des bases de données de descriptions uniformes étaient disponibles dans les applications d’interviews assistées par ordinateur (IAO), et un code a pu être attribué au moment de la collecte par suite d’une recherche dans la base de données appropriée. Toutes les descriptions sans code ont été extraites au moment du traitement et codées manuellement. Au cours de l’enquête, on a attribué manuellement un numéro d’identification de médicament (DIN) à 1 832 médicaments et autres produits de santé, et un code de marque à 154 noms de marques de cigarettes. Pour ce qui est de l’affectation du code du Système de classification des industries de l’Amérique du Nord (SCIAN) de 2002 et de la Classification nationale des professions pour statistiques (CNP‑S) de 2001, les 3 485 enregistrements comportant des données dans les champs de descriptions d’emplois ont été extraits et envoyés pour que l’industrie et la profession fassent l’objet d’un codage manuel. On a procédé à un appariement préliminaire en fonction d’une base de données de descriptions codées précédemment afin de fournir un point de départ au codage manuel.
7.4 Vérification
La majeure partie de la vérification des données a été effectuée au moment des interviews par l’application d’IAO. Les intervieweurs ne pouvaient pas entrer de valeurs non valides et les erreurs d’enchaînement ont fait l’objet de l’instruction de contrôle programmée « passez à ». Par exemple, dans le cadre de l’IAO, on s’est assuré de ne pas poser de questions non pertinentes aux répondants. Les vérifications nécessitant des mesures correctives ont été intégrées dans l’application d’IAOafin de traiter les réponses incohérentes, et des avertissements ne nécessitant pas de mesures correctives ont aussi été inclus afin de déterminer les valeurs inhabituelles (c.‑à‑d. improbables plutôt qu’impossibles), en vue de déceler les erreurs possibles et de les corriger à la source.
Au bureau central, les données ont été assujetties à une série d’étapes de traitement qui ont pu occasionner certains redressements. Comme étape de validation finale, les contrôles d’IAO ont été appliqués de nouveau aux données traitées. Par conséquent, les données définitives étaient complètes et contenaient des codes de réserve pour les réponses « Moins que la limite de détection », « Sans objet », « Ne sait pas », « Refus » et « Non déclaré ».
Étiquette de code de réserve |
Code de réserve |
|---|---|
Moins que la limite de détection |
9,5; 99,5 etc. |
Sans objet |
6; 96; 99,6 etc. |
Ne sait pas |
7; 97; 99,7 etc. |
Refus |
8; 98; 99,8 etc. |
Non déclaré |
9; 99; 99,9 etc. |
7.5 Création de variables dérivées
Des variables dérivées pour le cycle 1 de l’Enquête canadienne sur les mesures de la santé (ECMS) ont été créées pour faciliter l’analyse des données et pour réduire le risque d’erreurs. Les trois types les plus courants de variables dérivées ont été créés : en regroupant les données concernant une variable; en combinant les données d’une ou de plusieurs questions d’enquête pour un répondant; ou en combinant les données de plus d’un répondant. Les variables dérivées comportent généralement un « D » ou un « G » au quatrième caractère du nom de la variable.
Trois autres types de variables dérivées se trouvent dans le fichier de données du cycle 1 de l’ECMS : conversion des réponses fournies selon diverses unités de temps (jours, semaines, mois ou années) en un type d’unité, par exemple, annuelle; calcul de l’indice de masse corporelle (IMC) et création de l’Indice de l’état de santé, qui est fondé sur les réponses à une série de questions.
Des spécifications ont été reçues et comprenaient des détails sur la façon de créer chaque variable dérivée. Le cycle 1 de l’ECMS compte 599 variables dérivées. La moitié ont été créées à l’intérieur de l’application de saisie, afin de pouvoir fournir des résultats initiaux aux répondants à la fin de leur visite au CEM, et le reste des variables dérivées a été créé après le traitement des données.
Toutes les variables dérivées ont subi un processus de validation après leur création afin de veiller à ce que le produit comporte les données requises. Des modifications ont dû être apportées aux spécifications si, au moment de la validation par des experts spécialisés, on a déterminé que le produit des variables dérivées comportait des lacunes. De la documentation complète pour l’ensemble des variables dérivées du cycle 1 se trouve dans la documentation relative aux variables dérivées (voir l’annexe 5).
7.6 Limite de détection
Les données des vagues 2 et 3 n’ont jamais été recueillies ni diffusées par Statistique Canada auparavant. Ces données diffèrent des données d’enquête habituelles recueillies par interview ou des données obtenues au moyen de mesures physiques réelles. La grande majorité des données diffusées des vagues 2 et 3 proviennent des échantillons de sang et d’urine recueillis dans les centres d’examen mobiles.
Une fois recueillis, les échantillons sont envoyés aux laboratoires à fins d’analyse. Les instruments et méthodes utilisés pour faire les analyses ont des limites en ce qui concerne les quantités qui peuvent effectivement être décelées dans les échantillons de sang et d’urine. Par conséquent, de temps en temps, les résultats sont transmis par les laboratoires avec un code indiquant que le résultat pour un échantillon particulier est supérieur ou inférieur au niveau de concentration qui peut être mesuré par l’instrument utilisé pour le test en question.
Au cours du traitement des données, cette information est restituée par un code de réserve.
7.7 Intervalle de référence
Habituellement appelée fourchette normale, une fourchette de référence est un intervalle dans lequel se situent les valeurs observées auprès de 95 % de la population. Les fourchettes sont établies au cours du temps en appliquant les tests à un grand nombre de personnes. Elles donnent une indication des valeurs habituellement observées dans la population sur laquelle sont faites les mesures, mais ne sont pas les fourchettes optimales pour la santé.
Les fourchettes de référence peuvent varier en fonction de facteurs tels que l’âge, le sexe et la race. Les instruments utilisés dans le laboratoire peuvent aussi avoir une incidence sur ces fourchettes. Par conséquent, les fourchettes de référence sont fournies par chaque laboratoire, pour chaque type de test qu’il exécute, pour une période spécifiée. Les fourchettes peuvent changer au cours du temps à mesure qu’évoluent les caractéristiques de la population étudiée.
En ce qui concerne les tests effectués sur les échantillons recueillis dans le cadre de l’ECMS, un document donnant la liste des fourchettes de référence pour chaque test peut être obtenu sur demande. Comme les fourchettes sont fournies par les divers laboratoires qui effectuent les tests, Statistique Canada les communique aux utilisateurs des données à titre d’information uniquement.
8. Structure des fichiers de données
8.1 Description des fichiers de données
Les fichiers de diffusion comprennent uniquement les données des répondants qui se sont rendus au centre d’examen mobile (CEM) et qui ont convenu de partager leurs réponses avec Santé Canada et l’Agence de la santé publique du Canada. Dans le cas du cycle 1 de l’Enquête canadienne sur les mesures de la santé (ECMS), une fois le traitement terminé et les enregistrements non partagés supprimés, 5 604 enregistrements sont demeurés dans le fichier maître principal.
À la fin de la diffusion du cycle 1, neuf fichiers comprenant des données de l’ECMS auront été diffusés. Un fichier comprendra l’ensemble des variables dérivées des ménages, de la visite au CEM, de l’ensemble des échantillons de laboratoire et du moniteur d’activité. Six fichiers comprendront les données de laboratoire sous-échantillonnées, un fichier comprendra les variables dérivées du moniteur d’activité physique des répondants qui ont porté leur moniteur pendant quatre jours ou plus, et un fichier comprendre les données sur les médicaments. Un fichier supplémentaire contenant les données météorologiques et relatives à la qualité de l’air d’Environnement Canada a également été diffusé.
| Vague 1 | Données des ménages et du CEM | Janvier 2010 |
|---|---|---|
| Vague 2 | Données des analyses de laboratoire (excluant les mesures environnementales) + fichier du sous- échantillon des répondants sélectionnés qui ont jeûné | Mars 2010 |
| Vague 3 | Données des analyses de laboratoire (incluant les mesures environnementales) + trois fichiers de sous‑échantillon | Août 2010 |
| Vague 4 | Données du moniteur d’activité + fichier du sous- échantillon des répondants qui ont porté leur moniteur pendant quatre jours ou plus | Novembre 2010 |
| Diffusion des données supplémentaire | Fichier maître avec 2.4.D mise à jour fichier du sous- échantillon du Tabac:
Fichier du sous- échantillon des Phtalate |
Avril 2011 |
L’échantillon de base de l’enquête englobe les répondants de 6 à 79 ans. Toutefois, certaines mesures ou certains tests ont été effectués uniquement pour un sexe, pour des répondants à jeun ou pour un sous-groupe d’âge aléatoire. Voir le chapitre 4 pour obtenir des renseignements détaillés au sujet du contenu de l’enquête.
8.1.1 Vague 1 : Fichier maître
Le premier fichier de données comprend les réponses recueillies lors des interviews auprès des ménages et de la visite au CEM, ainsi que les variables dérivées créées par les applications de collecte et celles créées après le traitement des données. Les 5 604 enregistrements correspondent à un enregistrement par répondant qui s’est rendu au CEM et qui a participé à au moins quelques-unes des mesures, puis qui a consenti à ce que les résultats soient communiqués à Santé Canada et à l’Agence de la santé publique du Canada.
Les données comprises dans ce fichier portent sur les sujets suivants :
- Consommation d’alcool
- Anthropométrie
- Santé cardiovasculaire et condition physique
- Problèmes de santé chroniques
- État de santé général
- Fonction respiratoire
- Consommation de médicaments
- Aptitudes musculosquelettiques
- Nutrition
- Santé bucco-dentaire
- Activité physique
- Grossesse
- Santé sexuelle
- Sommeil
- Usage du tabac
- Exposition au soleil
8.1.2 Vague 2 : Fichier maître
Ce fichier créé contient toutes les données de la vague 1 et le premier ensemble de variables de laboratoire. Ces variables contiennent les données de laboratoire sur la santé cardiovasculaire, la batterie d’analyses chimiques, le diabète, l’état de santé général, les marqueurs de maladies infectieuses, la santé des reins et l’état nutritionnel.
8.1.3 Vague 2 : Sous-échantillon des répondants à jeun
Ce fichier contient des données d’un sous-ensemble de répondants de l’ECMS, soit ceux qui ont jeûné pour au moins 10 heures. Le fichier contient les variables suivantes :
- Apolipoprotéine A1
- Apolipoprotéine B
- Lipoprotéines de basse densité (LDL)
- Triglycérides
- Insuline
Il est à noter que ce fichier comporte une pondération spécifique à cette sous-population.
8.1.4 Vague 3 : Fichier maître
Ce fichier créé contient toutes les données des vague 1 et 2, ainsi que les variables de laboratoire sur les contaminants environnementaux et les substances chimiques. Ces variables contiennent les données de laboratoire sur le bisphénol A, la cotinine, les métaux, les pesticides organophosphorés, les herbicides du type phénoxy (2,4-D, 2,4-DCP) et les pesticides pyréthroïdes.
8.1.5 Vague 3 : Fichiers de sous-échantillon
Trois fichiers de sous-échantillon ont étaient diffusé à la vague 3. Les fichiers contiennent des données d’un sous-ensemble des répondant de l’ECMS.
| Fichiers de sous-échantillon | Échantillon |
|---|---|
| 1) PFCS: | |
| - Composés perfluorés (PFHxS, PFOS, PFOA) | 20 à 79 (s) |
| 2) PBDE: | |
| - Pesticides organochlorés | 20 à 79 ans (s) (à jeun) |
| - Biphényles polychlorés (BPC) | |
| - Biphényles polybromés (PBB) | |
| - Éthers diphényliques polybromés (PBDE) | |
| 3) BIHG | |
| - Mercure inorganique - Sang | 6 à 79 (s) |
| (s) = certains tests de laboratoire sont effectués uniquement pour un sous‑groupe aléatoire de la fourchette d’âge indiquée | |
Il est à noter que ces fichiers comportent une pondération spécifique à cette sous-population.
8.1.6 Vague 4 : Fichier maître
Le fichier créé pour cette diffusion contient toutes les données des fichiers maîtres des vagues 1, 2 et 3, ainsi que 98 variables dérivées des moniteurs d’activité.
8.1.7 Vague 4 : Fichier de sous-échantillon
Ce fichier contient les données d’un sous-ensemble de répondants à l’ECMS, soit ceux qui ont porté leur moniteur d’activité pendant au moins quatre jours. Le fichier contient les 98 variables dérivées des moniteurs d’activité. Il contient également une pondération propre à cette sous-population.
8.1.8 Diffusion des données supplémentaire : Fichier principal
Le fichier créé pour cette diffusion contient toutes les données des fichiers principaux des vagues 1, 2 et 3, sous réserve des changements suivants :
- Les données sur les médicaments ont été retirées et intégrées à un fichier distinct.
- Les données 2,4-D ont été mises à jour.
8.1.9 Diffusion des données supplémentaire : Fichier sur les médicaments
Pour faciliter l’utilisation des données sur les médicaments recueillies dans le cadre de l’ECMS au moment de l’interview à domicile et de la visite à la clinique, une base de données distincte contenant toutes les réponses aux questions portant sur les médicaments a été créée. Cette base de données contient des renseignements sur tous les répondants et utilise donc le même poids que le fichier maître de la vague 1 –WGT_FULL.
Durant l’interview à domicile, on a demandé aux répondants d’indiquer tous médicaments sur ordonnance, médicaments en vente libre et produits de santé ou remèdes à base de plantes médicinales qu’ils ont pris au cours du mois précédent. L’intervieweur a pu saisir des données portant sur jusqu’à 15 médicaments sur ordonnance, 15 médicaments en vente libre et 15 produits de santé ou remèdes à base de plantes médicinales, pour un total de 45 entrées possibles.
Durant la visite à la clinique, la consommation continue de chaque médicament, produit en vente libre et produit de santé ou remède à base de plantes médicinales déclaré au moment de l’interview à domicile a été confirmée. Les répondants ont eu l’occasion alors d’ajouter jusqu’à cinq nouveaux médicaments sur ordonnance, cinq nouveaux produits en vente libre et cinq nouveaux produits de santé ou remèdes à base de plantes médicinales dont ils ont commencé à faire usage après l’interview.
À partir de ces données, on a créé une série de variables dérivées indiquant où les produits ont été déclarés, le nombre total de produits déclarés et le moment de leur dernière consommation selon le type de produit (médicaments sur ordonnance, produits en vente libre ou produits de santé ou remèdes à base de plantes médicinales). En outre, des codes ATC et AHFS ont été attribués à chaque médicament déclaré; un deuxième code AHFS a été ajouté au besoin.
Convention appliquée pour nommer les variables
Conformément aux règles générales de la convention appliquée pour nommer les variables de l’ECMS, les noms des variables dans la base de données des médicaments se limitent à huit caractères et chaque caractère du nom de la variable contient des renseignements sur les données contenues dans la variable.
Positions 1-3 :
- « MED » ou « MHR » : variables recueillies ou dérivées à partir des interviews à domicile et/ou à la clinique
- « ATC » : variables du Système de classification anatomique, thérapeutique et clinique (ATC)
- « AHF » : variables du Système de classification de l’American Hospital Formulary Service (AHFS)
Position 4 : Indique si la variable a été recueillie durant l’interview à domicile ou à la clinique (« _ ») ou si elle a été dérivée par la suite (« D »).
Position 5 : Indique la catégorie de médicaments :
- « 1 » : médicaments sur ordonnance
- « 2 » : médicaments en vente libre
- « 3 » : produits de santé ou remèdes à base de plantes médicinales
Positions 6-7 : Indiquent le numéro de liste du médicament :
- « 01 » à « 15 » : médicaments sur lesquels des données ont été recueillies au moment de l’interview à domicile et qui ont ensuite été confirmés lors de la visite à la clinique
- « 31 » à « 35 » : médicaments supplémentaires sur lesquels des données ont été recueillies au moment de la visite à la clinique
Description des variables clés
NOTA : Les variables sont décrites ci‑dessous. Un « X » figure en position 5 du nom de la variable puisque la même logique s’applique à chaque catégorie de médicaments (médicaments sur ordonnance, médicaments en vente libre et produits de santé ou produits à base de plantes médicinales).
La variable MEDDX00A indique si le répondant a ou n’a pas pris un médicament figurant dans une catégorie donnée au cours du dernier mois. La variable MEDDX00B est la somme des médicaments dans une catégorie donnée pris par le répondant au cours du dernier mois. Les deux variables, MEDDX00A et MEDDX00B, sont dérivées des données recueillies au moment de l’interview à domicile et lors de la visite à la clinique. Pour plus de renseignements, voir Documentation des variables dérivées.
Il convient de souligner que, même si un maximum de 20 médicaments ont été saisis (15 lors de l’interview à domicile et 5 lors de la visite à la clinique) pour chaque catégorie de médicaments, la valeur indiquée pour MEDDX00B représente le nombre réel de médicaments dans une catégorie donnée pris par le répondant et, par conséquent, peut être supérieure à 20. Étant donné les limites de l’application de saisie des données, des détails sont disponibles seulement sur les premiers 20 médicaments déclarés. Par exemple, si au moment de l’interview à domicile un répondant a indiqué prendre 17 différents médicaments sur ordonnance au cours du dernier mois, alors MEDD100B est égal à 17, même si les détails ont été saisis seulement pour les premiers 15 des 17 médicaments prescrits.
Six variables supplémentaires sont associées à chacun des médicaments déclarés dans une catégorie donnée au moment de l’interview à domicile et cinq variables additionnelles sont associées à chaque nouveau médicament déclaré lors de la visite à la clinique.
MEDDX01A à MEDDX15A et MEDDX31A à MEDDX35A
Cette variable est dérivée des données recueillies à la clinique durant la confirmation de la consommation de médicaments déclarée au moment de l’interview à domicile. Elle indique si le répondant prenait encore les médicaments, s’il avait arrêté de prendre les médicaments depuis l’interview à domicile ou s’il n’avait jamais pris les médicaments.
ATC_X01A à ATC_X15A et ATC_X31A à ATC_X35A
Code ATC dérivé du numéro d’identification de médicament (DIN) recueilli au moment de l’interview à domicile et/ou de l’interview à la clinique.
AHF_X01A à AHF_X15A et AHF_X31A à AHF_X35A
Premier code AHFS dérivé du DIN recueilli au moment de l’interview à domicile et/ou de l’interview à la clinique.
Nota : Si le DIN d’un médicament donné n’était pas disponible, le code AHF figurant dans la base de données est « Non déclaré ».
AHF_X01B à AHF_X15B et AHF_X31B à AHF_X35B
Deuxième code AHFS dérivé du DIN recueilli au moment de l’interview à domicile et/ou de l’interview à la clinique (le cas échéant).
Nota : Si le DIN d’un médicament donné n’était pas disponible, le code AHF figurant dans la base de données est « Non déclaré ».
MED_X01B à MED_X15B
Ces données ont été recueillies durant l’interview à domicile et indiquent la dernière fois que le répondant a pris chaque médicament à partir du moment de l’interview à domicile.
Nota : On suggère d’utiliser cette variable aux fins d’analyse si l’on tâche d’établir un lien entre la consommation de médicaments et une ou plusieurs autres variables provenant de l’interview à domicile.
MHR_X01B à MHR_X15B et MHRDX31B à MHRDX35B
Ces variables sont recueillies à la clinique et indiquent la dernière fois que le répondant a pris chaque médicament à partir du moment de l’interview à la clinique.
Nota : Il est suggéré d’utiliser cette variable aux fins d’analyse si l’on tâche d’établir un lien entre la consommation de médicaments et une ou plusieurs autres variables provenant de la visite à la clinique.
8.1.10 Diffusion des données supplémentaire : Fichiers de sous-échantillon
Deux autres fichiers de sous-échantillon ont été diffusés. Ces fichiers contenaient les données d’un sous-ensemble de répondants à l’ECMS.
| Fichier de sous-échantillon | Échantillon | ||
|---|---|---|---|
| 1) Phtalates : | |||
| - Phtalates | 6 à 49 | ||
| 2) Tabac : | |||
| - Nicotine | 12 à 79 (s) | ||
| - NNAL (4-(methylnitrosoamino)-1-(3-pyridyl)-1-butanol) | |||
| - les metabolites de la nicotine | |||
| (s) = seul un sous-groupe aléatoire de la tranche d’âge indiquée est assujetti à certains tests de laboratoire | |||
À noter que chacun de ces fichiers contient un poids propre à la sous-population du fichier.
8.2 Variables clés pour le couplage des fichiers de données
Étant donné le grand nombre de fichiers diffusés pour le cycle 1, il importe d’assurer le couplage à ces fichiers pour avoir accès à un plus vaste répertoire d’information. Cela s’applique également aux fichiers de sous-échantillon.
Afin de faciliter le couplage de deux fichiers ou plus, une variable permettant d’identifier chaque répondant dans chaque fichier est requise. Pour ce qui est de l’ECMS, la variable à utiliser s’appelle CLINICID. Grâce à cette variable, les utilisateurs de données peuvent coupler les données du fichier maître et de tous les fichiers de sous-échantillon pour un répondant particulier.
8.3 Variables clés et définitions
D’autres variables, qui seront particulièrement utiles pour les utilisateurs des données, sont énumérées ci-après :
| CLC_AGE | Âge du répondant au moment de la visite au centre d’examen mobile |
|---|---|
| CLC_SEX | Sexe du répondant |
| DHH_MS | État matrimonial du répondant |
| EDUDR04 | Plus haut niveau d'études - répondant, 4 niveaux |
| EDUDR10 | Plus haut niveau d'études - répondant, 10 niveaux) |
| PROXY | Interview par procuration ou non |
| WGT_FULL | Poids du fichier de l’échantillon complet et fichier sur les médicaments |
| WGT_FAST | Poids du fichier du sous-échantillon des répondants à jeun |
| WGT_PFCS | Poids du fichier du sous-échantillon des PFCS |
| WGT_PBDE | Poids du fichier du sous-échantillon des PBDE |
| WGT_BIHG | Poids du fichier du sous-échantillon des BIHG |
| WGT_ACMO | Poids du fichier du sous-échantillon du moniteur d’activité |
| WGT_PHTH | Poids du fichier du sous-échantillon des phtalates |
| WGT_SMOK | Poids du fichier du sous-échantillon du tabac |
Les questionnaires auprès des ménages et de la partie clinique sont joints au présent document en annexe (voir l’annexe 6) en ce qui a trait aux renseignements concernant les questions posées aux répondants. Un cliché d’enregistrement pour toutes les variables du fichiers est aussi joint en annexe au présent document (voir l’annexe 7). Les dictionnaires de données, qui comprennent des descriptions et des caractéristiques de toutes les variables diffusées, sont disponibles sur demande. Chaque fichier diffusé aura son propre dictionnaire.
9. Pondération
Pour que les estimations produites à partir de données d’enquête soient représentatives de la population couverte, et non pas seulement de l’échantillon comme tel, l’utilisateur doit incorporer les facteurs de pondération, appelés ici les poids d’enquête, dans ses calculs. Un poids d’enquête est attribué à chaque personne incluse dans l’échantillon final, c’est-à-dire dans l’échantillon de personnes ayant répondu à l’ensemble de l’enquête. Ce poids correspond au nombre de personnes représentées par le répondant dans l’ensemble de la population.
Tel que décrit au chapitre 5 (Plan d’échantillonnage), l’Enquête canadienne sur les mesures de la santé (ECMS) a recours à deux bases de sondage pour la sélection de son échantillon : une base aréolaire d’unités géographiques (grappes) pour la construction et la sélection des sites de collecte et une base aréolaire de logements à l’intérieur de chaque site.
Selon la stratégie de pondération, on multiplie les poids de sélection des sites de collecte aux poids de sélection des logements (ménages) ajustés pour la non‑réponse. Après la transformation des poids des ménages en poids affectés aux personnes, ces derniers sont ajustés pour la non‑réponse lors de l’interview et lors de la visite au centre d’examen mobile (CEM), puis, moyennant quelques ajustements supplémentaires, ce poids devient le poids final affecté aux personnes.
9.1 Poids de sélection des sites de collecte
La première étape est de calculer le poids de sélection de chaque site de collecte. Pour chaque site, ce poids est calculé de la manière suivante à l’intérieur de chacune des limites régionales types8 (LRT) :
Poids de sélection d’un site de collecte à l’intérieur d’une LRT donnée9 =
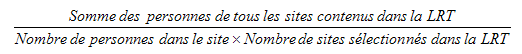
Il n’y a pas d’ajustement de non-réponse au niveau des sites de collecte, puisque tous les sites sélectionnés faisaient partie de l’enquête.
9.2 Poids de sélection des logements
Pour chacun des sites de collecte sélectionnés, une liste de tous les logements provenant du Recensement de 2006 a été obtenue. Ces logements ont été stratifiés en six groupes correspondant aux cinq strates selon le groupe d’âge et à la strate autres en utilisant la composition du ménage, comme décrit à la section 5.3.2 (Échantillonnage des logements). Plan d’échantillonnage. L’échantillon de logements a ensuite été réparti parmi ces strates.
Pour un logement donné, le poids de sélection était égal à l’inverse de la probabilité de sélection du logement à l’intérieur de la strate à laquelle il appartient.
Ce poids était ensuite multiplié par le poids de sélection des sites de collecte.
9.3 Retrait des unités hors champ
Parmi tous les logements échantillonnés, une certaine proportion de ceux-ci est identifiée comme étant hors du champ de l’enquête au moment de la collecte. Les logements détruits ou en construction; les logements vacants, saisonniers ou secondaires; les établissements; ainsi que les logements dont tous les membres du ménage sont âgés de moins de 6 ans, de plus de 79 ans ou sont membres à temps plein des Forces canadiennes sont des exemples de cas hors champ pour l’ECMS. Ces logements sont tout simplement retirés de l’échantillon, ne laissant plus que les logements faisant partie du champ de l’enquête. Les logements qui restent dans l’échantillon conservent le même poids qu’à l’étape précédente.
9.4 Non-réponse au niveau du ménage
Lors de la collecte, une certaine proportion des ménages échantillonnés a inévitablement résulté en une non-réponse. Ceci survient habituellement lorsque le ménage refuse de participer à l’enquête, fournit des données inutilisables, ou encore ne peut être joint pour réaliser l’interview. Le poids des ménages non répondants est redistribué aux ménages répondants à l’intérieur de groupes homogènes de réponse (GHR). Dans le but de créer ces GHR, la méthode du score basée sur une régression logistique est utilisée afin de déterminer la probabilité de réponse, puis ces probabilités sont utilisées afin de diviser l’échantillon par groupes ayant des propriétés de réponse similaires. Puisque l’information disponible pour les logements (ménages) non répondants est limitée, le modèle de régression comprend quelques variables provenant du Recensement de 2006, comme le type de logement, des informations géographiques ainsi que des paradonnées, ce qui inclut le nombre de semaines entre le premier et le dernier contact. Un facteur d’ajustement a donc été calculé à l’intérieur de chaque GHR de la façon suivante :
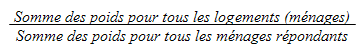
Le poids des ménages répondants est multiplié par ce facteur d’ajustement pour produire le poids des ménages ajusté. Les ménages non répondants sont éliminés du processus de pondération à partir de ce point.
9.5 Création du poids affecté aux personnes
Puisque l’unité d’échantillonnage finale pour l’ECMS est la personne, le poids des ménages ajusté jusqu’ici doit être converti en un poids affecté aux personnes. Celui-ci est obtenu en multipliant le poids des ménages ajusté par l’inverse de la probabilité de sélection de la personne choisie dans le ménage. Rappelons que la probabilité de sélection de la personne change en fonction du nombre de personnes dans le ménage et de l’âge des personnes (voir la section 5.3.3 Échantillonnage des répondants pour plus de détails).
9.6 Non-réponse au niveau du questionnaire
Dans le cadre de l’ECMS, le processus de collecte se déroule en trois étapes. Dans un premier temps, l’intervieweur obtient la liste complète des personnes vivant dans le ménage, puis interviewe la personne ou les personnes sélectionnées dans le ménage. Finalement, la personne ou les personnes sélectionnées se présentent au CEM de l’ECMS.
Dans certains cas, les intervieweurs ne réussissent qu’à compléter la première étape, soit parce qu’ils ne peuvent entrer en contact avec les personnes sélectionnées, soit parce que la personne ou les personnes sélectionnées refusent d’être interviewées. De tels cas sont définis comme étant des non-réponses au niveau du questionnaire, et un facteur d’ajustement doit être appliqué aux poids des personnes répondant au questionnaire pour compenser cette non-réponse. Tout comme pour la non-réponse au niveau du logement (ménage), l’ajustement est appliqué à l’intérieur de classes définies à partir des caractéristiques disponibles pour les répondants et les non-répondants. Toutes les caractéristiques recueillies lors du listage des membres du ménage (comme le nombre de personnes dans le ménage), ainsi que l’information géographique et les paradonnées, étaient en fait disponibles pour créer ces classes. La méthode du « score » est utilisée afin de définir les classes. Un facteur d’ajustement est calculé à l’intérieur de chaque classe de la façon suivante :
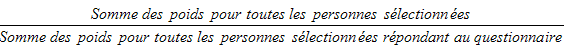
Le poids des personnes répondant au questionnaire est multiplié par ce facteur d’ajustement. Les personnes ne répondant pas au questionnaire sont éliminées de la pondération à partir de ce point.
9.7 Non-réponse au niveau du centre d’examen mobile (CEM)
Les répondants au questionnaire sont ensuite invités à se présenter au CEM de l’ECMS pour la prise des mesures physiques. Dans certains cas, les personnes refusent de participer ou ne se présentent pas à leur rendez-vous au CEM. De tels cas sont définis comme étant des non-réponses au niveau du CEM, et un facteur d’ajustement doit être appliqué aux poids des personnes se présentant au CEM pour compenser cette non-réponse. Tout comme pour la non-réponse au niveau du logement (ménage) et au niveau du questionnaire, l’ajustement est appliqué à l’intérieur de classes définies à partir des caractéristiques disponibles pour les répondants et les non-répondants. Toutes les caractéristiques recueillies sur le questionnaire lors de l’interview (comme la classe de revenu, le fait que le répondant ait ou non un emploi), ainsi que l’information géographique et les paradonnées, étaient en fait disponibles pour créer ces classes. La méthode du « score » est utilisée afin de définir les classes. Un facteur d’ajustement est calculé à l’intérieur de chaque classe de la façon suivante :
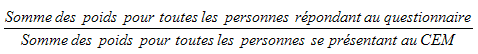
Le poids des personnes se présentant au CEM est multiplié par ce facteur d’ajustement. Les personnes ne s’étant pas présentées au CEM sont éliminées.
9.8 Winsorization
Il est à noter que, suivant la série d’ajustements appliqués sur les poids, il est possible que certaines unités se retrouvent avec des poids se démarquant des autres poids au point même d’en devenir aberrants. Certains répondants peuvent effectivement représenter une proportion anormalement élevée dans leur groupe et ainsi influencer fortement les estimations et la variance. Afin d’éviter cette situation, le poids des répondants qui contribue de façon aberrante à leur groupe âge-sexe est ajusté à la baisse selon une méthode appelée « winsorization ».
9.9 Calage aux marges
La dernière étape nécessaire afin d’obtenir le poids final de l’ECMS est le calage aux marges. Le calage est appliqué afin de s’assurer que la somme des poids finaux correspond aux estimations de populations définies à l’échelle des cinq régions géographiques canadiennes, pour chacun des 10 groupes d’âge-sexe d’intérêt, c’est-à-dire les cinq groupes d’âge 6 à 11 ans, 12 à 19 ans, 20 à 39 ans, 40 à 59 ans et 60 à 79 ans pour chacun des deux sexes.
Les estimations de population sont basées sur les comptes du recensement les plus récents, de même que sur les comptes des naissances, des décès, de l’immigration et de l’émigration depuis le recensement. La moyenne des estimations mensuelles (couvrant la période d’enquête) pour chacun des croisements des limites régionales types et des groupes d’âge-sexe a été retenue pour réaliser le calage. Après le calage, l’ajustement de poids est obtenu. Le poids résultant correspond au poids final de l’ECMS que l’on retrouve dans le fichier de données portant le nom de variable WGT_FULL.
9.10 Sous-échantillon de personnes à jeun
Les étapes décrites dans les sections 9.1 à 9.4 ont été appliquées au sous-échantillon de personnes à jeun. Lors de la création du poids des personnes (section 9.5), l’indicateur du sous-échantillon à jeun attribué aux logements (section 5.3.2.1) a été redistribué à la (aux) personne(s) sélectionnée(s). Avant l’ajustement de la non-réponse au niveau du questionnaire (section 9.6), les poids des personnes sélectionnées pour être à jeun ont été ajustés pour incorporer le poids d’échantillonnage du sous-échantillon à jeun. Un facteur d’ajustement est calculé par site de collecte et par strate de la façon suivante :

Le poids des personnes sélectionnées pour être à jeun a donc été multiplié par ce facteur d’ajustement. Les personnes qui n’ont pas été sélectionnées pour être à jeun sont éliminées de la pondération à partir de ce point.
L’ajustement de la non-réponse au niveau du questionnaire et au niveau du CEM (section 9.6 et 9.7) a été effectué sur le sous-échantillon de personnes à jeun.
Une étape additionnelle a été ajoutée pour les personnes qui ont été sélectionnées pour être à jeun, mais qui ne l’étaient pas ou qui n’ont pas donné de sang. Ces cas sont considérés comme de la non-réponse au sous-échantillon à jeun, et pour compenser pour cette non-réponse, un facteur d’ajustement a été appliqué aux poids des personnes étant à jeun et ayant donné du sang. Comme c’est le cas pour la non-réponse aux niveaux du logement (ménage), du questionnaire et du CEM, l’ajustement est appliqué à l’intérieur de classes définies à partir des caractéristiques disponibles pour les répondants et les non-répondants. Toutes les caractéristiques recueillies sur le questionnaire lors de l’intreview auprès du ménage et lors de la visite au CEM, en plus de l’information géographique et des paradonnées, étaient en fait disponibles pour créer ces classes. La méthode du “score” est utilisée afin de définir les classes. Un facteur d’ajustement est calculé à l’intérieur de chaque classe de la façon suivante :
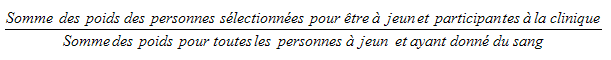
Le poids des personnes à jeun et ayant donné du sang a donc été multiplié par ce facteur d’ajustement. Les personnes n’étant pas à jeun ou n’ayant pas donné de sang sont éliminées.
Les deux étapes finales, winsorization et calage aux marges (sections 9.8 et 9.9) ont été appliquées au sous-échantillon de personnes à jeun. Après le calage, on obtient l’ajustement de poids. Le poids résultant est le poids final retrouvé dans le fichier du sous-échantillon de personnes à jeun portant le nom de la variable WGT_FAST.
9.11 Sous-échantillon de l'éther diphénylique polybromé (EDP)/des biphényles polychlorés (BPC)
Les étapes décrites à la section 9.10 (sous‑échantillon de personnes à jeun) ont été exécutées. Seuls les répondants de 20 ans et plus (au moment de l’interview à domicile) faisant partie du sous‑échantillon de personnes à jeun ont été gardés. Le poids résultant correspond au poids final de l’ECMS que l’on retrouve dans le fichier de données du sous‑échantillon de l’EDP/des BPC portant le nom de la variable WGT_PBDE.
9.12 Sous-échantillon du mercure inorganique
Les étapes décrites dans les sections 9.1 à 9.4 ont été appliquées au sous‑échantillon du mercure inorganique. Au moment de la création du poids des personnes (section 9.5), l’indicateur du sous‑échantillon du mercure inorganique attribué aux logements (voir la section 5.3.2.3) a été attribué à la (aux) personne(s) sélectionnée(s). Avant l’ajustement de la non-réponse au niveau du questionnaire (section 9.6), les poids des personnes sélectionnées pour le sous‑échantillon du mercure inorganique ont été ajustés pour incorporer les poids d’échantillonnage du sous‑échantillon du mercure inorganique. Un facteur d’ajustement est calculé par site de collecte et par strate de la façon suivante :
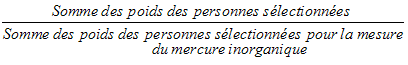
Le poids des personnes sélectionnées pour la mesure du mercure inorganique a donc été multiplié par ce facteur d’ajustement. Les personnes qui n’ont pas été sélectionnées pour la mesure du mercure inorganique sont éliminées de la pondération à partir de ce point.
L’ajustement de la non‑réponse au niveau du questionnaire et au niveau du CEM (sections 9.6 et 9.7) a été effectué sur le sous‑échantillon du mercure inorganique.
Une étape additionnelle a dû être ajoutée pour tenir compte des personnes sélectionnées pour faire partie du sous‑échantillon du mercure inorganique mais chez lesquelles la mesure n’a pu être prise. Ces cas sont considérés comme étant des cas de non‑réponse au sous‑échantillon du mercure inorganique et, pour compenser pour cette non‑réponse, un facteur d’ajustement a été appliqué aux poids des personnes pour lesquelles on disposait d’une mesure valide du niveau de mercure inorganique. Comme c’est le cas pour la non-réponse aux niveaux du logement (ménage), du questionnaire et du CEM, l’ajustement est appliqué à l’intérieur de classes définies à partir des caractéristiques disponibles pour les répondants et les non‑répondants. Toutes les caractéristiques recueillies dans le questionnaire lors de l’interview auprès du ménage et lors de la visite au CEM, en plus de l’information géographique et des paradonnées, étaient en fait disponibles pour créer ces classes. La méthode du « score » est utilisée pour définir les classes. Un facteur d’ajustement est calculé à l’intérieur de chaque classe de la façon suivante :

Le poids des personnes qui ont été sélectionnées pour la mesure du mercure inorganique et pour lesquelles ont disposait d’une mesure valide a donc été multiplié par ce facteur d’ajustement. Les personnes pour lesquelles on ne disposait pas de mesure valide sont éliminées.
Les deux étapes finales, winsorization et calage (voir les sections 9.8 et 9.9), ont été appliquées au sous‑échantillon du mercure inorganique. Après le calage, on obtient l’ajustement de poids. Le poids résultant correspond au poids final de l’ECMS que l’on retrouve dans le fichier de données du sous‑échantillon du mercure inorganique portant le nom de la variable WGT_BIHG.
9.13 Sous-échantillon des composés perfluorés
Les étapes décrites dans les sections 9.1 à 9.4 ont été appliquées au sous‑échantillon des composés perfluorés. Au moment de la création du poids des personnes (section 9.5), l’indicateur du sous‑échantillon des composés perfluorés attribué aux logements (voir la section 5.3.2.4) a été attribué à la (aux) personne(s) sélectionnée(s). Avant l’ajustement de la non-réponse au niveau du questionnaire (section 9.6), les poids des personnes sélectionnées pour le sous‑échantillon des composés perfluorés ont été ajustés pour incorporer les poids d’échantillonnage du sous‑échantillon des composés perfluorés. Un facteur d’ajustement est calculé par site de collecte et par strate de la façon suivante :

Le poids des personnes sélectionnées pour la mesure des composés perfluorés a donc été multiplié par ce facteur d’ajustment. Les personnes qui n’ont pas été sélectionnées pour la mesure des composés perfluorés sont éliminées de la pondération à partir de ce point.
L’ajustement de la non‑réponse au niveau du questionnaire et au niveau du CEM (sections 9.6 et 9.7) a été effectué sur le sous‑échantillon des composés perfluorés.
Une étape additionnelle a dû être ajoutée pour tenir compte des personnes sélectionnées pour faire partie du sous‑échantillon des composés perfluorés mais chez lesquelles la mesure n’a pu être prise. Ces cas sont considérés comme étant des cas de non‑réponse au sous‑échantillon des composés perfluorés et, pour compenser pour cette non‑réponse, un facteur d’ajustement a été appliqué aux poids des personnes pour lesquelles on disposait d’une mesure valide du niveau de composés perfluorés. Comme c’est le cas pour la non-réponse aux niveaux du logement (ménage), du questionnaire et du CEM, l’ajustement est appliqué à l’intérieur de classes définies à partir des caractéristiques disponibles pour les répondants et les non‑répondants. Toutes les caractéristiques recueillies dans le questionnaire lors de l’interview auprès du ménage et lors de la visite au CEM,en plus de l’information géographique et des paradonnées, étaient en fait disponibles pour créer ces classes. La méthode du « score » est utilisée pour définir les classes. Un facteur d’ajustement est calculé à l’intérieur de chaque classe de la façon suivante :

Le poids des personnes sélectionnées pour la mesure des composés perfluorés et pour lesquelles ont disposait d’une mesure valide a donc été multiplié par ce facteur d’ajustment. Les personnes pour lesquelles on ne disposait pas de mesure valide sont été éliminées.
Les deux étapes finales, winsorization et calage (voir les sections 9.8 et 9.9), ont été appliquées ensuite au sous‑échantillon des composés perfluorés. Après le calage, on obtient l’ajustement de poids. Le poids résultant correspond au poids final de l’ECMS que l’on retrouve dans le fichier de données du sous‑échantillon des composés perfluorés portant le nom de la variable WGT_PFCS.
9.14 Pondération des moniteurs d’activité
Les étapes décrites aux sections 9.1 à 9.7 ont été réalisées. Des moniteurs d’activité devaient être offerts à tous les participants à la clinique une fois leur visite terminée. Cependant, par suite de problèmes techniques, l’appareil n’a pas été offert à tous les participants. On doit donc tenir compte des participants à qui on n’avait pas offert de prendre part à cette composante de l’enquête. Le poids des répondants à qui un moniteur d’activité a été offert a été gonflé pour tenir compte de la pondération des répondants à la clinique qui n’ont pas reçu l’offre. Un facteur d’ajustement a été calculé par site de collecte et par strate, de la façon suivante :

Le poids des personnes à qui un moniteur d’activité a été offert a donc été multiplié par ce facteur d’ajustement. Les personnes à qui aucun moniteur d’activité n’avait été offert ont été éliminées.
Une étape additionnelle a dû être ajoutée pour tenir compte des personnes à qui un moniteur d’activité avait été offert mais qui n’avaient pas quatre jours et plus d’entrées valides. Ces cas sont considérés comme étant des cas de non-réponse et un facteur d’ajustement a été appliqué au poids des personnes qui avaient quatre jours et plus d’entrées valides. Comme c’est le cas pour la non-réponse aux niveaux du site de collecte et du logement (ménage) et à la clinique, l’ajustement est appliqué à l’intérieur des classes définies à partir des caractéristiques disponibles pour les répondants et les non-répondants. Toutes les caractéristiques recueillies dans le questionnaire lors de l’interview ainsi que les mesures prises à la clinique, en plus de l’information géographique et des paradonnées, étaient en fait disponibles pour créer ces classes. La méthode des « scores » est utilisée pour définir les classes. Un facteur d’ajustement est calculé à l’intérieur de chaque classe de la façon suivante :
![]()
Le poids des personnes qui ont des entrées valides pendant quatre jours ou plus dans leur moniteur d’activité a donc été multiplié par ce facteur d’ajustement. Les personnes qui avaient moins de quatre jours d’entrées valides ont été éliminées.
Les deux étapes finales, winsorisation et calage (voir les sections 9.8 et 9.9), ont été appliquées aux répondants. Après le calage, on obtient l’ajustement de poids. Le poids résultant correspond au poids final de l’ECMS que l’on retrouve dans le fichier de données des moniteurs d’activité portant le nom de la variable WGT_ACMO.
9.15 Sous-échantillon des phtalates
Les étapes décrites aux sections 9.1 à 9.4 ont été réalisées pour le sous-échantillon des phtalates. À l’étape de la création du poids des personnes (section 9.5), l’indicateur du sous-échantillon des phtalates attribué aux logements (section 5.3.2.5) a été redistribué à la (aux) personne(s) sélectionnée(s). Avant l’ajustement de la non-réponse au niveau du questionnaire (section 9.6), les poids des personnes sélectionnées pour le sous-échantillon des phtalates ont été ajustés de manière à incorporer les poids du sous-échantillon des phtalates. Un facteur d’ajustement a été calculé par site de collecte et par strate de la façon suivante :
![]()
Le poids des personnes sélectionnées pour les phtalates a donc été multiplié par ce facteur d’ajustement. Les personnes qui n’ont pas été sélectionnées pour les phtalates ont été éliminées.
L’ajustement de la non-réponse au niveau du questionnaire et au niveau du CEM (sections 9.6 et 9.7) a été effectué sur le sous-échantillon des phtalates.
Une étape supplémentaire était nécessaire pour les personnes sélectionnées dans le sous-échantillon des phtalates, mais pour lesquelles il a été impossible de procéder aux mesures. Ces cas sont considérés comme des non-réponses pour le sous-échantillon des phtalates; pour compenser la non-réponse, un facteur d’ajustement a été appliqué aux poids des personnes pour lesquelles la mesure des phtalates était valide. Comme pour la non-réponse aux niveaux du site de collecte et du logement (ménage) et à la clinique, l’ajustement est appliqué dans des classes définies à partir des caractéristiques disponibles pour les répondants et les non-répondants. Toutes les caractéristiques recueillies dans le questionnaire lors de l’interview et toutes les mesures prises à la clinique, en plus de l’information géographique et des paradonnées, étaient disponibles pour la création de ces classes. La méthode du « score » est utilisée pour définir les classes. Un facteur d’ajustement est calculé à l’intérieur de chaque classe de la façon suivante :
![]()
Le poids des personnes ayant été sélectionnées pour les phtalates et pour lesquelles il y a une mesure valide a donc été multiplié par ce facteur d’ajustement. Les personnes pour lesquelles il n’y avait pas de mesure valide ont été éliminées.
Les deux étapes finales, la winsorisation et le calage aux marges (sections 9.8 et 9.9), ont ensuite été appliquées au sous-échantillon des phtalates. L’ajustement des poids a été obtenu après le calage. Le poids résultant correspond au poids final de l’ECMS qui se trouve dans le fichier du sous-échantillon des phtalates portant le nom de la variable WGT_PHTH.
9.16 Sous-échantillon du tabac
Les étapes décrites aux sections 9.1 à 9.7 ont été réalisées. Les composantes étant mesurées chez les participants à la clinique qui ont fourni un échantillon d’urine et ont consenti à ce que cet échantillon soit entreposé pour des études ultérieures sur la santé, un facteur d’ajustement était nécessaire pour compenser ceux qui n’ont pas fourni d’urine ou n’ont pas consenti. Comme c’est le cas pour la non-réponse aux niveaux du site de collecte et du logement (ménage) et à la clinique, l’ajustement est appliqué dans les classes définies à partir des caractéristiques disponibles pour les répondants et les non-répondants. Toutes les caractéristiques recueillies dans le questionnaire lors de l’interview et toutes les mesures prises à la clinique, en plus de l’information géographique et des paradonnées, étaient disponibles pour la création de ces classes. La méthode du « score » est utilisée pour définir les classes. Un facteur d’ajustement est calculé à l’intérieur de chaque classe de la façon suivante :
![]()
Le poids des personnes ayant fourni un échantillon et ayant consenti à ce qu’il soit utilisé pour des études ultérieures a donc été multiplié par ce facteur d’ajustement. Les personnes qui n’ont pas fourni d’échantillon d’urine ou qui n’ont pas consenti à ce que leur urine soit utilisée pour des études ultérieures ont été éliminées.
Chacun des participants à la clinique âgé de 12 à 79 ans a été affecté à une strate définie par un groupe d’âge (12 à 19 ans, 20 à 39 ans, 40 à 59 ans et 60 à 79 ans) et l’état quant au tabagisme (fumeur, non-fumeur exposé à la fumée et non-fumeur non exposé à la fumée). Environ 2 500 personnes ont été sélectionnées parmi les participants pour le sous-échantillon de la nicotine. Certains répondants ont été exclus parce qu’il ne restait pas suffisamment d’urine pour l’analyse, surtout parce que leur urine avait été utilisée pour d’autres études. Ces exclusions ont été considérées comme aléatoires. Pour compenser et pour tenir compte des poids du sous-échantillon de la nicotine, il faut appliquer un facteur d’ajustement aux poids des participants dont l’urine a été analysée pour l’étude sur la nicotine. Le facteur d’ajustement est calculé dans chacun des groupes d’âge par strate d’état quant au tabagisme de la façon suivante :

Le poids des personnes de 12 à 79 ans pour qui l’analyse de la nicotine a été effectuée a donc été multiplié par ce facteur d’ajustement. Les personnes pour qui l’analyse de la nicotine n’a pas été faite ont été éliminées.
Les deux étapes finales, la winsorisation et le calage aux marges (voir les sections 9.8 et 9.9), ont été appliquées au sous-échantillon du tabac. L’ajustement des poids a été obtenu après le calage. Le poids résultant correspond au poids final de l’ECMS qui se trouve dans le fichier du sous-échantillon de la nicotine portant le nom de la variable WGT_SMOK.
10. Qualité des données
10.1 Taux de réponse
Au total, 8 772 des logements sélectionnés dans le cadre de l’Enquête canadienne sur les mesures de la santé (ECMS) faisaient partie du champ de l’enquête10. Parmi ces logements, 6 106 ont accepté de donner la composition du ménage, ce qui donne un taux de réponse à l’échelle du ménage de 69,6 %. Parmi ces ménages répondants, 7 483 personnes ont été sélectionnées (une ou deux personnes par ménage) pour participer à l’enquête. Parmi les personnes sélectionnées, 6 604 ont accepté de répondre au questionnaire, ce qui donne un taux de réponse de 88,3 %. De ces personnes, 5 604 se sont ensuite présentées au centre d’examen mobile (CEM) de l’ECMS pour la prise de mesures physiques, ce qui donne un taux de réponse de 84,9 %. À l’échelle canadienne, un taux de réponse combiné de 51,7 % a été observé pour le cycle 01 de l’ECMS. Il est important de mentionner que le taux de réponse combiné n’est pas obtenu en multipliant les taux de réponse au niveau du ménage et de la personne (au niveau du questionnaire et au niveau du CEM), puisque deux personnes ont été sélectionnées dans certains ménages. L’annexe 9a donne les taux de réponse combinés ainsi que l’information pertinente au calcul de ceux-ci pour chaque site.
On décrit dans ce qui suit de quelle façon les différentes composantes de l’équation doivent être manipulées afin de calculer correctement les taux de réponse combinés.
Taux de réponse au niveau du ménage
![]()
Taux de réponse au niveau de la personne parmi les ménages où une personne a été sélectionnée (questionnaire)

Taux de réponse au niveau de la personne parmi les ménages où deux personnes ont été sélectionnées (questionnaire)

Taux de réponse au niveau de la personne parmi les ménages où une personne a été sélectionnée (CEM)

Taux de réponse au niveau de la personne parmi les ménages où deux personnes ont été sélectionnées (CEM)

Rapport pour les ménages où une personne a été sélectionnée
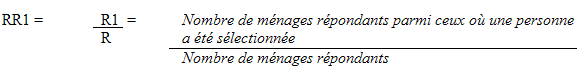
Note : Le « Nombre de ménages répondants parmi ceux où une personne a été sélectionnée » est ni plus ni moins que le nombre de personnes sélectionnées parmi les ménages où une personne a été sélectionnée de de l’annexe 9a.
Rapport pour les ménages où deux personnes ont été sélectionnées (base aréolaire)

Note : Il est important de mentionner que le « Nombre de ménages répondants parmi ceux où deux personnes ont été sélectionnées » est obtenu en divisant par deux le nombre de personnes sélectionnées parmi les ménages où deux personnes ont été sélectionnées de l’annexe 9a.
Une fois que toutes les composantes ci-dessus ont été calculées, un utilisateur peut calculer le taux de réponse combiné en utilisant la formule suivante :
Taux de réponse combiné
COMBRR = HR * [(RR1 *PQ1 * PC1) + (RR2 * PQ2 * PC2)]
Voici un exemple du calcul du taux de réponse au niveau du ménage pour le Canada en utilisant l’information fournie dans l’annexe 9a.

Voici maintenant un exemple de calcul du taux de réponse combiné pour le Canada en utilisant l’information fournie dans l’annexe 9a.
HR = 6 106/8 772 = = 0,696
PQ1 = 4 158/4 734 = 0,878
PC1 = 3 463/4 158 = 0,833
PQ2 = 2 446/2 744 = 0,891
PC2 = 2 141/2 446 = 0,875
RR1 = 4 734/6 106 = 0,775
RR2 = 2 744/2/6 106 = 0,225
Taux de réponse combiné = 0,696 * [(0,775 * 0,878 * 0,833) + (0,225 * 0,891 * 0,875)]
= 0,517
= 51,7 %
10.1.1 Taux de réponse des prélèvements de sang et d’urine
Même si le fichier avec les résultats d’analyse de laboratoire inclut tous les participants à la clinique, certaines analyses n’ont pu être faites parce que les répondants n’ont pas ou ne pouvaient pas donner de sang ou d’urine. Des 5 604 participants qui se sont présentés au centre d’examen mobile de l’ECMS pour les mesures physiques, 5 373 participants ont donné du sang et 5 540 ont donné de l’urine. Le taux de réponse combiné pour le prélèvement de sang est de 50,0 % alors que le taux de réponse combiné pour l’urine est de 51,2 % Il est important de mentionner que le taux de réponse combiné n’est pas obtenu en multipliant les taux de réponse au niveau du ménage et de la personne, puisque deux personnes ont été sélectionnées dans certains ménages. L’annexe 9b donne les taux de réponse combinés ainsi que l’information pertinente au calcul de ceux-ci pour chaque site.
On décrit dans ce qui suit de quelle façon les différentes composantes de l’équation doivent être manipulées afin de calculer correctement les taux de réponse combinés. Quatre taux de réponse additionnels sont requis pour dériver les taux de réponse combinés pour les prélèvements de sang et d’urine :
Taux de réponse au niveau de la personne parmi les ménages où une personne a été sélectionnée (prélèvement de sang)

Taux de réponse au niveau de la personne parmi les ménages où deux personnes ont été sélectionnées (prélèvement de sang)

Taux de réponse au niveau de la personne parmi les ménages où une personne a été sélectionnée (urine)

Taux de réponse au niveau de la personne parmi les ménages où deux personnes ont été sélectionnées (urine)

Taux de réponse combiné pour le prélèvement de sang
BCOMBRR = HR * [ (RR1 *PQ1 * PC1 * BC1 ) + ( RR2 * PQ2 * PC2 * BC2 )]
Taux de réponse combiné pour l’urine
UCOMBRR = HR * [ (RR1 *PQ1 * PC1 * UC1 ) + ( RR2 * PQ2 * PC2 * UC2) ]
où HR, RR1, PQ1, PC1, RR2, PQ2 et PC2 sont décrits à la section 10.1.
Voici maintenant un exemple de calcul du taux de réponse combiné pour le prélèvement de sang pour le Canada en utilisant l’information fournie dans l’annexe 9a et 9b.
HR = 6 106/8 772 = 0,696
PQ1 = 4 158/4 734 = 0,878
PC1 = 3 463/4 158 = 0,833
PQ2 = 2 446/2 744 = 0,891
PC2 = 2 141/2 446 = 0,875
RR1 = 4 734/6 106 = 0,775
RR2 = 2 744/2/6 106 = 0,225
BC1 = 3 397/3 463 = 0,981
BC2 = 1 976/2 141 = 0,923
Taux de réponse combiné pour le prélèvement de sang =
0,696 * [ (0,775 * 0,878 * 0,833 * 0,981) + ( 0,225 * 0,891 * 0,875 * 0,923) ]
= 0,500
= 50,0%
10.1.2 Taux de réponse pour le sous-échantillon de personnes à jeun
Parmi les 6 106 ménages répondants, 3 948 personnes ont été sélectionnées (une ou deux personnes par ménage) pour le sous-échantillon à jeun, parmi lesquelles 3 483 ont répondu au questionnaire ce qui donne un taux de réponse de 88,2%. De ces personnes, 2 969 se sont ensuite présentées au centre d’examen mobile (CEM) de l’ECMS pour la prise de mesures physiques, ce qui donne un taux de réponse de 85,2%. De ces personnes, 2,634 étaient à jeun et ont donné du sang. À l’échelle canadienne, un taux de réponse combiné de 46,3% a été observé. Il est important de mentionner que le taux de réponse combiné n’est pas obtenu en multipliant les taux de réponse au niveau du ménage et de la personne, puisque deux personnes ont été sélectionnées dans certains ménages. L’annexe 9c donne les taux de réponse combinés ainsi que l’information pertinente au calcul de ceux-ci pour chaque site.
On décrit dans ce qui suit de quelle façon les différentes composantes de l’équation doivent être manipulées afin de calculer correctement les taux de réponse combinés.
Taux de réponse au niveau de la personne parmi les ménages où une personne a été sélectionnée pour le sous-échantillon de personnes à jeun (questionnaire)

Taux de réponse au niveau de la personne parmi les ménages où deux personnes ont été sélectionnées pour le sous-échantillon de personnes à jeun (questionnaire)

Taux de réponse au niveau de la personne parmi les ménages où une personne a été sélectionnée pour le sous-échantillon de personnes à jeun (CEM)

Taux de réponse au niveau de la personne parmi les ménages où deux personnes ont été sélectionnées pour le sous-échantillon de personnes à jeun (CEM)

Taux de réponse au niveau de la personne parmi les ménages où une personne a été sélectionnée pour le sous-échantillon de personnes à jeun (personne à jeun et ayant donné du sang)

Taux de réponse au niveau de la personne parmi les ménages où deux personnes ont été sélectionnées pour le sous-échantillon de personnes à jeun (personne à jeun et ayant donné du sang)

Taux de réponse combiné pour le sous-échantillon de personnes à jeun
FSCOMBRR = HR* [(RR1*FSQ1*FSC1*FSB1) + (RR2*FSQ2* FSC2* FSB2 )]
où HR, RR1 and RR2 sont décrits à la section 10.1.
Voici maintenant un exemple de calcul du taux de réponse combiné pour le sous-échantillon de personnes à jeun pour le Canada en utilisant l’information fournie dans l’annexe 9a et 9c.
HR = 6 106/8 772 = 0,696
FSQ1 = 2 206/2 522= 0,875
FSC1 = 1 840/2 206= 0,834
FSQ2 = 1 277/1 426 = 0,896
FSC2 = 1 129/1 277 = 0,884
RR1 = 4 734/6 106 = 0,775
RR2 = 2 744/2/6 106 = 0,225
FSB1 = 1 672/1 840 = 0,909
FSB2 = 962/1 129= 0,852
Taux de réponse combiné pour le sous-échantillon de personnes à jeun=
0,696 * [ (0,775 * 0,875 * 0,834 * 0,909) + ( 0,225 * 0,896 * 0,884 * 0,852) ]
= 0,463
= 46,3%
10.1.3 Taux de réponse du sous-échantillon de l’éther diphénylique polybromé (EDP)/des biphényles polychlorés (BPC)
Parmi les 6 106 ménages répondants, 2 513 personnes ont été sélectionnées pour faire partie du sous‑échantillon de l’EDP/des BPC, dont 2 203 ont répondu au questionnaire, donnant un taux de réponse de 87,7 %. De ces personnes, 1 841 se sont ensuite présentées au centre d’examen mobile de l’ECMS pour la prise de mesures physiques, ce qui donne un taux de réponse de 83,6 %. Parmi ces personnes, 1 696 étaient à jeun et ont donné du sang. À l’échelle du Canada, un taux de réponse combiné de 47,0 % a été observé. Il importe de souligner que le taux de réponse combiné n’est pas nécessairement obtenu en multipliant les taux de réponse au niveau de la personne et du ménage, puisque deux personnes ont été sélectionnées dans certains ménages. L’annexe 9d donne les taux de réponse combinés du sous‑échantillon de l’EDP/des BPC ainsi que l’information pertinente au calcul de ces taux pour chaque site.
On décrit ci‑dessous de quelle façon les différentes composantes de l’équation doivent être manipulées afin de calculer correctement le taux de réponse combiné.
Taux de réponse au questionnaire au niveau de la personne pour le sous‑échantillon de l’EDP/des BPC chez les ménages où une personne a été sélectionnée

Taux de réponse au questionnaire au niveau de la personne pour le sous‑échantillon de l’EDP/des BPC chez les ménages où deux personnes ont été sélectionnées

Taux de réponse au volet clinique au niveau de la personne pour le sous‑échantillon de l’EDP/des BPC chez les ménages où une personne a été sélectionnée

Taux de réponse au volet clinique au niveau de la personne pour le sous‑échantillon de l’EDP/des BPC chez les ménages où deux personnes ont été sélectionnées

Taux de réponse au niveau de la personne des personnes à jeun et ayant donné du sang pour le sous‑échantillon de l’EDP/des BPC chez les ménages où une personne a été sélectionnée

Taux de réponse au niveau de la personne des personnes à jeun et ayant donné du sang pour le sous‑échantillon de l’EDP/des BPC chez les ménages où deux personnes ont été sélectionnées

Taux de réponse combiné du sous‑échantillon de l’EDP/des BPC
PBCOMBRR = HR* [(RR1*PBCQ1*PBCC1*PBCB1) + (RR2*PBCQ2* PBCC2* PBCB2 )]
où HR, RR1 et RR2 sont décrits à la section 10.1.
Voici maintenant un exemple de calcul du taux de réponse combiné pour le sous‑échantillon de l’EDP/des BPC pour le Canada en utilisant les renseignements fournis aux annexes l’annexe 9a et 9d.
HR = 6 106 / 8 772 = 0,696
PPBCQ1 = 1 745 / 1 983 = 0,880
PPBCC1 = 1 438 / 1 745 = 0,824
PPBCQ2 = 458 / 530 = 0,864
PPBCC2 = 403 / 458 = 0,880
PRR1 = 4 734 / 6 106 = 0,775
PRR2 = 2 744/2 / 6 106 = 0,225
PPBCB1 = 1 324 / 1 438 = 0,921
PPBCB2 = 372 / 403 = 0,923
Taux de réponse combiné pour le sous‑échantillon de l’EDP/des BPC =
0,696 * [ (0,775 * 0,880 * 0,824 * 0,921) + ( 0,225 * 0,864 * 0,880 * 0,923) ]
= 0,470
= 47,0 %
10.1.4 Taux de réponse du sous‑échantillon du mercure inorganique
Parmi les 6 106 ménages répondants, 1 592 personnes ont été sélectionnées pour faire partie du sous‑échantillon du mercure inorganique, dont 1 414 ont répondu au questionnaire, donnant un taux de réponse de 88,8 %. De ces personnes, 1 191 se sont ensuite présentées au centre d’examen mobile de l’ECMS pour la prise de mesures physiques, ce qui donne un taux de réponse de 84,2 %. Une mesure a été prise chez 1 123 de ces personnes. À l’échelle du Canada, un taux de réponse combiné de 49,4 % a été observé. Il importe de souligner que le taux de réponse combiné n’est pas nécessairement obtenu en multipliant les taux de réponse au niveau de la personne et du ménage, puisque deux personnes ont été sélectionnées dans certains ménages. L’annexe 9e donne les taux de réponse combinés du sous‑échantillon du mercure inorganique ainsi que l’information pertinente au calcul de ces taux pour chaque site.
On décrit ci‑dessous de quelle façon les différentes composantes de l’équation doivent être manipulées afin de calculer correctement le taux de réponse combiné.
Taux de réponse au questionnaire au niveau de la personne pour le sous‑échantillon du mercure inorganique chez les ménages où une personne a été sélectionnée

Taux de réponse au questionnaire au niveau de la personne pour le sous‑échantillon du mercure inorganique chez les ménages où deux personnes ont été sélectionnées

Taux de réponse au volet clinique au niveau de la personne pour le sous‑échantillon du mercure inorganique chez les ménages où une personne a été sélectionnée

Taux de réponse au volet clinique au niveau de la personne pour le sous‑échantillon du mercure inorganique chez les ménages où deux personnes ont été sélectionnées

Taux de réponse au niveau de la personne des personnes à jeun et ayant donné du sang pour le sous‑échantillon du mercure inorganique chez les ménages où une personne a été sélectionnée

Taux de réponse au niveau de la personne des personnes à jeun et ayant donné du sang pour le sous-échantillon du mercure inorganique chez les ménages où deux personnes ont été sélectionées

Taux de réponse combiné du sous‑échantillon du mercure inorganique
IMCOMBRR = HR* [(RR1*IMQ1*IMC1*IMB1) + (RR2*IMQ2* IMC2* IMB2)]
où HR, RR1 et RR2 sont décrits à la section 10.1.
Voici maintenant un exemple de calcul du taux de réponse combiné pour le sous‑échantillon du mercure inorganique pour le Canada en utilisant les renseignements fournis aux annexes 9a et 9e.
HR = 6 106 / 8 772 = 0,696
PIMQ1 = 868 / 981 = 0,885
PIMC1 = 719 / 868 = 0,828
PIMQ2 = 546 / 611 = 0,894
PIMC2 = 472 / 446 = 0,864
PRR1 = 4 734 / 6 106 = 0,775
PRR2 = 2 744/2 / 6 106 = 0,225
PIMB1 = 702 / 719 = 0,976
PIMB2 = 421 / 472 = 0,892
Taux de réponse combiné pour le sous‑échantillon du mercure inorganique =
0,696 * [ (0,775 * 0,885 * 0,828 * 0,976) + ( 0,225 * 0,894 * 0,864 * 0,892) ]
= 0,494
= 49,4 %
10.1.5 Taux de réponse du sous-échantillon des composés perfluorés
Parmi les 6 106 ménages répondants, 4 036 personnes ont été sélectionnées pour faire partie du sous‑échantillon des composés perfluorés, dont 3 563 ont répondu au questionnaire, donnant un taux de réponse de 88,3 %. De ces personnes, 2 971 se sont ensuite présentées au centre d’examen mobile de l’ECMS pour la prise de mesures physiques, ce qui donne un taux de réponse de 83,4 %. Une mesure a été prise chez 2 880 de ces personnes. À l’échelle du Canada, un taux de réponse combiné de 49,7 % a été observé. Il importe de souligner que le taux de réponse combiné n’est pas nécessairement obtenu en multipliant les taux de réponse au niveau de la personne et du ménage, puisque deux personnes ont été sélectionnées dans certains ménages. L’annexe 9f donne les taux de réponse combinés du sous‑échantillon des composés perfluorés ainsi que l’information pertinente au calcul de ces taux pour chaque site.
On décrit ci‑dessous de quelle façon les différentes composantes de l’équation doivent être manipulées afin de calculer correctement le taux de réponse combiné.
Taux de réponse au questionnaire au niveau de la personne pour le sous‑échantillon des composés perfluorés chez les ménages où une personne a été sélectionnée

Taux de réponse au questionnaire au niveau de la personne pour le sous‑échantillon des composés perfluorés chez les ménages où deux personnes ont été sélectionnées

Taux de réponse au volet clinique au niveau de la personne pour le sous‑échantillon des composés perfluorés chez les ménages où une personne a été sélectionnée

Taux de réponse au volet clinique au niveau de la personne pour le sous‑échantillon des composés perfluorés chez les ménages où deux personnes ont été sélectionnées

Taux de réponse au niveau de la personne des personnes à jeun et ayant donné du sang pour le sous‑échantillon des composés perfluorés chez les ménages où une personne a été sélectionnée

Taux de réponse au niveau de la personne des personnes à jeun et ayant donné du sang pour le sous‑échantillon des composés perfluorés chez les ménages où deux personnes ont été sélectionnées

Taux de réponse combiné du sous‑échantillon des composés perfluorés
PFCCOMBRR = HR* [(RR1*PFCQ1*PFCC1*PFCB1) + (RR2*PFCQ2* PFCC2* PFCB2)]
où HR, RR1 et RR2 sont décrits à la section 10.1.
Voici maintenant un exemple de calcul du taux de réponse combiné pour le sous‑échantillon de composés perfluorés pour le Canada en utilisant les renseignements fournis aux annexes 9a et 9f.
HR = 6 106 / 8 772 = 0,696
PPFCQ1 = 2 798 / 3 167= 0,883
PPFCC1 = 2 308/ 2 798 = 0,825
PPFCQ2 = 765 / 869 = 0,880
PPFCC2 = 663 / 765 = 0,867
PRR1 = 4 734 / 6 106 = 0,775
PRR2 = 2 744/2 / 6 106 = 0,225
PPFCB1 = 2 242 / 2 308 = 0,971
PPFCB2 = 638 / 663 = 0,962
Taux de réponse combiné pour le sous‑échantillon des composés perfluorés =
0,696 * [ (0,775 * 0,883 * 0,825 * 0,971) + ( 0,225 * 0,880 * 0,867 * 0,962) ]
= 0,497
= 49,7 %
10.1.6 Taux de réponse pour les moniteurs d’activité
Sur les 5 604 participants qui se sont présentés au centre d’examen mobile de l’ECMS pour la prise des mesures physiques, 5 468 d’entre eux se sont vu offrir un moniteur d’activité. Parmi ces personnes, 4 441 ont retourné le moniteur d’activité avec au moins quatre jours d’entrées valides. Le taux de réponse combiné pour le moniteur d’activité est de 41,8 %. Il est important de mentionner que le taux de réponse combiné n’est pas obtenu en multipliant les taux de réponse au niveau du ménage et de la personne puisque deux personnes ont été sélectionnées dans certains ménages. L’annexe 9g donne les taux de réponse combinés, ainsi que l’information pertinente au calcul de ceux‑ci pour chaque site.
On décrit dans ce qui suit de quelle façon les différentes composantes de l’équation doivent être manipulées afin de calculer correctement les taux de réponse combinés. Deux taux de réponse additionnels sont requis pour dériver les taux de réponse combinés du moniteur d’activité :
Taux de réponse au niveau de la personne parmi les ménages où une personne a été sélectionnée (moniteur d’activité)
AM1 = V1 / OF1 = Nombre de personnes qui ont retourné le moniteur d’activité avec au moins quatre jours d’entrées valides parmi les participants à la clinique chez qui une personne a été sélectionnée / Nombre de participants s’étant présentés à la clinique et à qui un moniteur d’activité a été offert parmi les ménages où une personne a été sélectionnée
Taux de réponse au niveau de la personne parmi les ménages où deux personnes ont été sélectionnées (moniteur d’activité)
AM2 = V2 / OF2 = Nombre de personnes qui ont retourné le moniteur d’activité avec au moins quatre jour d’entrées valides parmi les participants à la clinique chez qui deux personnes ont été sélectionnées / Nombre de personnes s’étant présentées à la clinique et à qui on a offert un moniteur d’activité parmi les ménages où deux personnes ont été sélectionnées
Taux de réponse combiné pour les moniteurs d’activité
AMCBRR = HR * [ (RR1 *PQ1 * PC1 * AM1 ) + ( RR2 * PQ2 * PC2 * AM2 )]
où HR, RR1, PQ1, PC1, RR2, PQ2 et PC2 sont décrits à la section 10.1.
Voici un exemple de calcul du taux de réponse combiné pour les moniteurs d’activité pour le Canada à l’aide de l’information fournie dans les annexes 9a et 9g.
HR = 6 106 / 8 772 = 0,696
PPQ1 = 4 158 / 4 734 = 0,878
PPC1 = 3 463 / 4 158 = 0,833
PPQ2 = 2 446 / 2 744 = 0,891
PPC2 = 2 141 / 2 446 = 0,875
PRR1 = 4 734 / 6 106 = 0,775
PRR2 = (2 744 / 2) / 6 106 = 0,225
PAM1 = 2 709 / 3 372 = 0,803
PAM2 = 1 732 / 2 096 = 0,826
Taux de réponse combiné pour les moniteurs d’activité =
0,696 * [ (0,775 * 0,878 * 0,833 * 0,803) + ( 0,225 * 0,891 * 0,875 * 0,826) ]
= 0,418
= 41,8 %
10.1.7 Taux de réponse du sous-échantillon des phtalates
Dans les 6 106 ménages répondants, 4 439 personnes ont été choisies pour le sous-échantillon des phtalates; 3 902 ont répondu au questionnaire, ce qui équivaut à un taux de réponse de 87,9 %. Parmi celles‑ci, 3 310, soit 84,8 %, se sont ensuite présentées au centre d’examen mobile de l’ECMS pour la prise des mesures physiques. Une mesure a été effectuée pour 3 237 d’entre elles. À l’échelle canadienne, un taux de réponse combiné de 50,1 % a été observé. Il est important de mentionner que multiplier les taux de réponse aux niveaux du ménage et de la personne ne permet pas nécessairement d’obtenir le taux de réponse combiné, puisque deux personnes ont été sélectionnées dans certains ménages. Les taux de réponse combinés du sous-échantillon des phtalates, ainsi que l’information pertinente au calcul de ceux‑ci pour chacun des sites, sont présentés à l’annexe 9h.
Ce qui suit est une description de la façon dont on doit manipuler les différentes composantes de l’équation pour calculer correctement le taux de réponse combiné.
Taux de réponse au questionnaire au niveau des personnes pour le sous-échantillon des phtalates parmi les ménages dans lesquels une personne a été sélectionnée
PHTQ1 = PHQ1 / PHPS1 = Nombre de répondants au questionnaire pour le sous-échantillon des phtalates parmi les ménages dans lesquels une personne a été sélectionnée / Nombre de personnes faisant partie du champ de l’enquête parmi les ménages dans lesquels une personne a été sélectionnée
Taux de réponse au questionnaire au niveau des personnes pour le sous-échantillon des phtalates parmi les ménages dans lesquels deux personnes ont été sélectionnées
PHTQ2 = PHQ2 / PHPS2 = Nombre de répondants au questionnaire pour le sous-échantillon des phtalates parmi les ménages dans lesquels deux personnes ont été sélectionnées / Nombre de personnes faisant partie du champ de l'enquête parmi les ménages dans lesquels deux personnes ont été sélectionnées
Taux de réponse de la clinique au niveau des personnes pour le sous-échantillon des phtalates parmi les ménages dans lesquels une personne a été sélectionnée
PHTC1 = PHC1 / PHQ1 = Nombre de participants à la clinique pour le sous-échantillon des phtalates parmi les ménages dans lesquels une personne a été sélectionnée / Nombre de répondants au questionnaire pour le sous-échantillon des phtalates parmi les ménages dans lesquels une personne a été sélectionnée
Taux de réponse de la clinique au niveau des personnes pour le sous-échantillon des phtalates parmi les ménages dans lesquels deux personnes ont été sélectionnées
PHTC2 = PHC2 / PHQ2 = Nombre de participants à la clinique pour le sous-échantillon des phtalates parmi les ménages dans lesquels deux personnes ont été sélectionnées / Nombre de répondants au questionnaire pour le sous-échantillon des phtalates parmi les ménages dans lesquels deux personnes ont été sélectionnées
Taux de réponse au niveau des personnes qui étaient à jeun et ont donné du sang pour le sous-échantillon des phtalates parmi les ménages dans lesquels une personne a été sélectionnée
PHTB1 = PHB1 / PHC1 = Nombre de participants qui étaient à jeun et ont donné du sang pour le sous-échantillon des phtalates parmi les participants à la clinique lorsqu'une personne a été sélectionnée / Nombre de participants à la clinique pour le sous-échantillon des phtalates parmi les ménages dans lesquels une personne a été sélectionnée
Taux de réponse à l'échelle des personnes qui étaient à jeun et ont donné du sang pour le sous-échantillon des phtalates parmi les ménages dans lesquels deux personnes ont été sélectionnées
PHTB2 = PHB2 / PHC2 = Nombre de participants qui étaient à jeun et ont donné du sang pour le sous-échantillon des phtalates parmi les participants à la clinique lorsque deux personnes ont été sélectionnées / Nombre de participants à la clinique pour le sous-échantillon des phtalates parmi les ménages dans lesquels deux personnes ont été sélectionnées
Taux de réponse combiné du sous-échantillon des phtalates
PHTCOMBRR = HR* [(RR1*PHTQ1*PHTC1*PHTB1) + (RR2*PHTQ2* PHTC2* PHTB2)]
où HR, RR1 et RR2 sont décrits à la section 10.1.
Voici maintenant un exemple de calcul, à l'aide de l'information fournie aux annexes 9a et 9h, du taux de réponse combiné pour le sous-échantillon des phtalates, pour le Canada.
HR = 6 106 / 8 772 = 0,696
PHTQ1 = 2 348 / 2 720 = 0,863
PHTC1 = 1 948 / 2 348 = 0,830
PHTQ2 = 1 554 / 1 719 = 0,904
PHTC2 = 1 362 / 1 554 = 0,876
RR1 = 4 734 / 6 106 = 0,775
RR2 = 2 744/2 / 6 106 = 0,225
PHTB1 = 1 921 / 1 948 = 0,986
PHTB2 = 1 316 / 1 362 = 0,966
Taux de réponse combiné pour le sous-échantillon des phtalates
0,696 * [ (0,775 * 0,863 * 0,830 * 0,986) + ( 0,225 * 0,904 * 0,876 * 0,966) ]
0,501
= 50,1 %
10.1.8 Taux de réponse du sous-échantillon du tabac
Parmi les 4 530 participants âgés de 12 à 79 ans qui se sont présentés au centre d’examen mobile de l’ECMS pour la prise des mesures physiques, 4 356 ont fourni un échantillon d’urine et ont consenti à ce qu’il soit entreposé pour des études ultérieures sur la santé. Le sous-échantillon du tabac a été sélectionné parmi ces participants. Le taux de réponse combiné a été de 50,1 %. Il est important de mentionner que multiplier les taux de réponse aux niveaux du ménage et de la personne ne permet pas d’obtenir le taux de réponse combiné puisque deux personnes ont été sélectionnées dans certains ménages. L’annexe 9i donne les taux de réponse combinés, ainsi que l’information pertinente au calcul de ceux‑ci, pour chaque site.
Ce qui suit est une description de la façon dont on doit manipuler les différentes composantes de l’équation pour calculer correctement les taux de réponse combinés. Deux autres taux de réponse sont nécessaires pour dériver les taux de réponse combinés pour le sous-échantillon du tabac.
Taux de réponse au niveau de la personne parmi les ménages dans lesquels une personne a été sélectionnée (tabac)
NN1= UC / C1 = Nombre de participants à la clinique ayant fourni un échantillon d'urine et consenti à ce qu'il soit entreposé pour des études ultérieures sur la santé dans les ménages dans lesquels une personne a été sélectionnée / Nombre de participants à la clinique parmi les ménages dans lesquels une personne a été sélectionnée
Taux de réponse au niveau de la personne parmi les ménages dans lesquels deux personnes ont été sélectionnées (tabac)
NN2= UC2 / C2 = Nombre de participants à la clinique ayant fourni un échantillon d'urine et consenti à ce qu'il soit entreposé pour des études ultérieures sur la santé dans les ménages dans lesquels deux personnes ont été sélectionnées / Nombre de participants à la clinique parmi les ménages dans lesquels deux personnes ont été sélectionnées
Taux de réponse combiné du sous-échantillon du tabac
NNCBRR = HR * NN1 ) + ( RR2 * PQ2 * PC2 * NN2 )]
où HR, RR1, PQ1, PC1, RR2, PQ2 et PC2 sont décrits à la section 10.1.
Voici maintenant un exemple de calcul à l’aide des renseignements fournis aux annexes 9a et 9i, du taux de réponse combiné, pour le sous-échantillon du tabac, pour le Canada.
HR = 6 106 / 8 772 = 0,696
PQ1 (12 à 79 ans seulement) = 4 156 / 4 732 = 0,878
PC1 (12 à 79 ans seulement) = 3 462 / 4 156 = 0,833
PQ2 (12 à 79 ans seulement) = 1 200 / 1 373 = 0,874
PC2 (12 à 79 ans seulement) = 1 068 / 1 200 = 0,890
RR1 = 4 734 / 6 106 = 0,775
RR2 = 2 744/2 / 6 106 = 0,225
NN1 (12 à 79 ans seulement) = 3 330 / 3 462 = 0,962
NN2 (12 à 79 ans seulement) = 1 026 / 1 068 = 0,961
Taux de réponse combiné pour le sous-échantillon du tabac =
0,696 * [ (0,775 * 0,878 * 0,833 * 0,962) + ( 0,225 * 0,874 * 0,890 * 0,961) ]
= 0,501
= 50.1%
10.2 Erreurs dans les enquêtes
L’enquête permet de produire des estimations fondées sur l’information recueillie à partir d’un échantillon de personnes. On aurait pu obtenir des estimations quelque peu différentes si on avait effectué un recensement complet en utilisant le même questionnaire, les mêmes intervieweurs, les mêmes spécialistes des mesures, les mêmes superviseurs, les mêmes méthodes de traitement, etc. que ceux utilisés pour l’enquête. La différence entre les estimations tirées de l’échantillon et celles qui découlent d’un dénombrement complet effectué dans des conditions semblables s’appelle l’erreur due à l’échantillonnage des estimations.
Les erreurs qui ne sont pas liées à l’échantillonnage peuvent être commises à presque toutes les étapes d’une enquête. Il est possible que les intervieweurs comprennent mal les instructions, que les répondants fassent des erreurs en remplissant le questionnaire, que les réponses soient mal saisies, que les mesures soient mal effectuées et que des erreurs se produisent au moment du traitement et de la totalisation des données. Tous ces exemples représentent des erreurs non dues à l’échantillonnage.
10.2.1 Erreurs non dues à l’échantillonnage
Sur un grand nombre d’observations, les erreurs aléatoires auront peu d’effet sur les estimations tirées de l’enquête. Toutefois, les erreurs qui se produisent systématiquement contribueront à créer des biais dans les estimations de l’enquête. On a consacré beaucoup de temps et d’efforts à réduire les erreurs non dues à l’échantillonnage dans l’enquête. Des mesures d’assurance de la qualité ont été appliquées à chaque étape du cycle de collecte et de traitement des données afin de contrôler la qualité des données. Plus de détails sur les mesures d’assurance de la qualité pour chaque étape de l’enquête sont fournis à la section 10.3 Assurance et contrôle de la qualité du présent chapitre.
L’effet de la non-réponse sur les résultats de l’enquête constitue une source importante d’erreurs non dues à l’échantillonnage dans les enquêtes. L’ampleur de la non-réponse varie de la non-réponse partielle (le fait de ne pas répondre à une ou plusieurs questions) à la non-réponse totale. Au cours du cycle 01 de l’Enquête canadienne sur les mesures de la santé (ECMS), il y a eu peu de non-réponse partielle, car une fois le questionnaire commencé, les répondants avaient tendance à le terminer. Il y a eu non-réponse totale lorsque la personne sélectionnée pour participer à l’enquête a refusé de le faire ou que l’intervieweur a été incapable d’entrer en contact avec elle. Dans certains sites de collecte, l’échantillon a été augmenté au cours de l’année afin d’atteindre la taille d’échantillon ciblée. Finalement, les cas de non-réponse totale ont été considérés lors de la pondération en corrigeant les poids affectés aux personnes qui ont répondu à l’enquête afin de compenser pour celles qui n’ont pas répondu. Voir le chapitre 9. Pondération pour plus de détails sur la correction de la pondération pour la non-réponse.
10.2.2 Erreurs dues à l’échantillonnage
Étant donné que les estimations d’une enquête par sondage comportent inévitablement des erreurs dues à l’échantillonnage, de bonnes méthodes statistiques exigent que les chercheurs fournissent aux utilisateurs une indication de l’ampleur de cette erreur. La mesure de l’importance éventuelle des erreurs dues à l’échantillonnage est fondée sur l’écart type des estimations tirées des résultats de l’enquête. Cependant, en raison de la grande diversité des estimations que l’on peut tirer d’une enquête, l’écart type d’une estimation est habituellement exprimé en fonction de l’estimation à laquelle il se rapporte. La mesure résultante, appelée coefficient de variation (CV), s’obtient en divisant l’écart type de l’estimation par l’estimation elle-même; on l’exprime en pourcentage de l’estimation.
Par exemple, supposons qu’une personne estime que 20 % des Canadiens âgés de 12 à 79 ans fument régulièrement et que cette estimation comporte un écart type de 0,005. On calcule alors le CV de cette estimation de la façon suivante :
(0,005/0,20) x 100 % = 2.5 %
Statistique Canada utilise fréquemment les résultats du CV pour l’analyse des données et conseille vivement aux utilisateurs produisant des estimations à partir des fichiers de données du cycle 01 de l’ECMS de faire de même.
| Type d’estimation | c.v. (en %) | Lignes directrices |
|---|---|---|
| Acceptable | 0,0 ≤ CV ≤ 16,6 | On peut envisager une diffusion générale non restreinte des estimations. Aucune annotation particulière n’est nécessaire. |
| Marginale | 16,6 < CV ≤ 33,3 | On peut envisager une diffusion générale non restreinte des estimations, en y joignant une mise en garde aux utilisateurs quant à la variabilité d’échantillonnage élevée liée aux estimations. Les estimations de ce genre doivent être identifiées par la lettre E (ou d’une autre manière similaire). |
| Inacceptable | CV > 33,3 | Statistique Canada recommande de ne pas publier des estimations dont la qualité est inacceptable. Toutefois, si l’utilisateur choisit de le faire, il doit alors adjoindre la lettre F (ou un autre identificateur semblable) et les diffuser avec l’avertissement suivant : « Nous avisons l’utilisateur que ... (précisez les données)... ne répondent pas aux normes de qualité de Statistique Canada pour ce programme statistique. Les conclusions tirées de ces données ne sauraient être fiables et seront fort probablement erronées. Ces données et toute conclusion qu’on pourrait en tirer ne devraient pas être publiées. Si l’utilisateur choisit de les publier, il est alors tenu de publier également le présent avertissement. » |
10.3 Assurance et contrôle de la qualité
De nombreux problèmes peuvent entraîner des erreurs dans les enquêtes reposant sur des mesures directes. Ces erreurs peuvent avoir des répercussions significatives sur l’intégrité des résultats de l’enquête. Afin de veiller à ce que l’Enquête canadienne sur les mesures de la santé (ECMS) réponde à ses objectifs, des mesures d’assurance et de contrôle de la qualité ont été mises en œuvre dans tous les processus. L’assurance de la qualité (AQ) permet d’anticiper les problèmes et comprend par conséquent les activités qui se déroulent avant la collecte des données ou qui servent à améliorer et à préciser la collecte. Le contrôle de la qualité (CQ) fait suite aux problèmes observés et comprend donc les activités qui se déroulent pendant et après la collecte des données. L’AQ et le CQ visent à assurer la fiabilité et la validité des données en vue de réduire le biais systématique au niveau le plus bas possible.
10.3.1 Formation du personnel chargé des interviews auprès des ménages et du centre d’examen mobile (CEM)
10.3.1.1 Formation initialeLa formation de tous les employés a permis de faire ressortir les buts et objectifs de l’enquête, la méthodologie de l’enquête et les lignes directrices pour le contrôle de la qualité. La formation portait en outre sur le contenu et les fonctions du questionnaire/de l’application, l’uniformisation des procédures d’enquête, la transmission des données, les techniques de conversion des refus et les procédures administratives.
La formation comprenait à la fois de la formation en salle de classe et la lecture obligatoire des procédures et des manuels de formation. Les exercices pratiques avec des instructeurs ont été au centre de la formation axée sur les différents postes. Des experts de divers domaines liés aux mesures de l’enquête (p. ex. la tension artérielle) et aux protocoles de collecte/de traitement des échantillons biologiques ont donné des séminaires aux employés compétents et ont participé à tous les aspects des exercices pratiques et de la répétition générale.
Intervieweurs des ménages :
Une semaine de formation a été donnée aux intervieweurs des ménages. Ces derniers ont participé à des interviews simulées pour se familiariser avec le questionnaire auprès des ménages, pour simuler les situations difficiles et pour mettre en pratique les situations possibles de non‑réponse. Ils ont aussi discuté de techniques pour traiter des questions délicates.
Une nouvelle formation a eu lieu avec les intervieweurs des ménages chaque fois qu’un changement a été apporté à l’application ou lorsque des précisions étaient nécessaires relativement au questionnaire auprès des ménages. De la formation formelle et informelle a été donnée de façon permanente, afin de veiller à ce que les protocoles appropriés soient suivis.
Personnel du CEM :
On a donné un mois de formation au personnel du CEM avant la collecte. Le personnel administratif a reçu de la formation particulière sur les techniques de conversion des refus, les techniques au téléphone et l’étalonnage et l’entretien de l’équipement dentaire.
Les spécialistes des mesures de la santé ont reçu de la formation additionnelle sur l’étalonnage et l’entretien de l’équipement, des lignes directrices sur la santé et la sécurité en milieu de travail (y compris la sécurité des répondants et du personnel), les procédures d’urgence et la sensibilisation des médias. Ils ont tous reçu une formation particulière relativement aux protocoles du Guide du conseiller CPHV 3, à la mesure de la tension artérielle et de la fréquence cardiaque, à la spirométrie et à la façon de tenir compte des besoins des personnes ayant une incapacité.
Les technologues de laboratoire ont reçu une formation supplémentaire sur le prélèvement, le traitement et l’entreposage des échantillons de sang et d’urine et sur l’exécution de tests de laboratoire, ainsi qu’une formation d’appoint sur l’application des protocoles de laboratoire.
Les dentistes ont reçu de la formation particulière relativement aux méthodes d’examen dentaire de l’ECMS et ont été évalués en fonction de la norme de l’Organisation mondiale de la santé s’appliquant aux dentistes.
L’agent de la logistique du site a reçu de la formation particulière sur l’aménagement des remorques pour le début de la collecte à chaque site et sur la préparation des remorques pour leur déplacement vers le site de collecte suivant, une fois la collecte terminée. Par ailleurs, les agents de la logistique du site ont reçu de la formation sur la technologie de l’information et le dépannage.
10.3.1.2 Répétition généraleAvant le début de l’enquête proprement dite, une répétition générale d’une durée d’un mois s’est déroulée à Ottawa avec les employés de Statistique Canada, de Santé Canada et de l’Agence de la santé publique du Canada et leurs parents intéressés. L’objectif de la répétition générale visait à permettre à la fois aux intervieweurs des ménages et au personnel du CEM de mettre à l’essai leurs compétences avant le début de la collecte. Le personnel du CEM a eu la possibilité d’aménager, de diriger et de préparer les remorques du CEM pour le transport vers un autre site, de la même façon que cela a été effectué pendant la collecte proprement dite. Il s’agissait notamment de fixer un rendez‑vous à des volontaires au CEM, à partir du même horaire que celui qui serait utilisé par les employés pour l’exploitation du site. La répétition générale a aussi permis au personnel du CEM de préciser l’enchaînement des activités au CEM et d’exécuter d’autres processus du CEM nécessitant une mise à l’essai (p. ex. l’expédition). La répétition générale a permis la vérification de l’exactitude de la documentation (p. ex. les manuels de procédures) et la compréhension par les intervieweurs des ménages et le personnel du CEM des procédures, procédés et enchaînements. Cela a aussi permis de déterminer les questions relatives à la formation/à la formation d’appoint avant la collecte sur le terrain.
10.3.1.3 Formation continue — Jour de l’exercice d’essaiAvant le début de la collecte à chaque site, une journée a été réservée pour que des volontaires de la collectivité visitent le CEM. On a appelé ces journées jours de l’exercice d’essai. L’objectif des exercices d’essai était d’assurer la formation continue de l’équipe du CEM. Cela lui a donné la possibilité de mettre en pratique ses compétences avant le début de la collecte à chaque site, ainsi que de s’assurer que tout l’équipement fonctionnait de façon appropriée.
10.3.1.4 Formation d’appoint annuelleAu milieu du cycle 1, les intervieweurs des ménages ont participé à une séance de compte rendu et de formation d’appoint. Au cours de cette séance, des questions ont été abordées, y compris la façon d’éviter les refus et les techniques de conversion, les techniques pour traiter la non‑réponse et la façon de traiter les questions de nature délicate.
Une formation d’appoint annuelle de huit jours a été offerte aux employés du CEM, au milieu du cycle 1, au bureau central. Ces séances s’apparentaient à la formation initiale et ont été menées en collaboration avec des experts des différents domaines liés à l’enquête, mais ont été axées sur des éléments nécessitant une formation d’appoint particulière.
10.3.2 Composante des ménages
10.3.2.1 Contrôle — Interview auprès des ménagesLe contrôle du travail effectué par les intervieweurs des ménages fait partie intégrante du contrôle des processus de collecte auprès des ménages. On a tenu des séances d’observation pour tous les intervieweurs au début du cycle de collecte et, par la suite, deux ou trois observations ont été effectuées à chacun des sites, ainsi que sur une base ponctuelle. Des séances de compte rendu ont été tenues dans 7 des 15 sites et ont donné lieu à l’examen des facteurs ayant des répercussions sur la qualité des données.
Outre le contrôle du travail des intervieweurs, le personnel du bureau central a procédé à des observations des interviews afin de vérifier les fonctions du système d’interview auprès des ménages, la compréhension par les répondants du contenu de l’enquête et l’utilité des outils de communication. Les observateurs ont soumis de la rétroaction à l’égard de ces questions aux équipes chargées de l’élaboration du contenu et des communications au bureau central, et les problèmes ont été résolus au besoin.
10.3.2.2 Taux de réponse au questionnaire auprès des ménagesLe contrôle des taux de réponse, dans le cadre de la collecte auprès des ménages, a été effectué tout au long du cycle par les employés du bureau central, qui ont rédigé des rapports sur les progrès de la collecte. Les employés ont contrôlé les raisons de la non‑réponse selon l’âge et le sexe, le nombre de tentatives de contact, la répartition des tentatives de contact selon le moment de la journée, les taux de refus et les tentatives de conversion des refus, ainsi que la répartition des étiquettes à jeun/non à jeun, afin d’obtenir le nombre cible de répondants selon le groupe d’âge et le sexe.
10.3.2.3 Validation des réponses au questionnaireÀ la fermeture de chaque site, les notes et les remarques ajoutées par les intervieweurs dans les fichiers de cas des répondants ont été passées en revue et des ajustements ont été apportés aux données, au besoin. En outre, la fréquence des catégories de réponses à une question a été déterminée pour « Autre – veuillez préciser », « Ne sait pas » et « Refus ». Les questions comportant un taux élevé de réponse à ces catégories ont fait l’objet d’un contrôle selon les taux prévus dans le cadre d’autres enquêtes sur la santé de Statistique Canada et ont fait l’objet d’un examen si le taux était plus élevé que prévu. Ces données ont aussi fait l’objet d’un contrôle entre les sites de collecte de l’ECMS afin de déterminer les problèmes propres à un site.
On a aussi procédé à la validation des réponses au questionnaire pour les questions incluses dans d’autres enquêtes sur la santé de Statistique Canada comportant un contenu similaire, à savoir les cycles 3.1 et 4.1 de l’Enquête sur la santé dans les collectivités canadiennes (ESCC).
10.3.3 Composante du centre d’examen mobile (CEM)
La section qui suit fournit des renseignements concernant les procédures d’assurance et de contrôle de la qualité qui ont été mises en place et qui sont propres à la collecte de mesures physiques et de données de laboratoire dans le cadre d’une visite au CEM.
10.3.3.1 Sélection de l’équipementLa qualité de l’équipement utilisé pour la collecte des données était essentielle pour assurer l’exactitude et la validité des données. Au moment de la sélection de l’équipement approprié, on a eu recours à une combinaison de conseils, de recherches, d’essais et d’évaluations. On a effectué cela en tenant compte des normes de l’industrie et de concert avec les partenaires (p. ex. Santé Canada, l’Agence de la santé publique du Canada), des experts d’autres enquêtes reposant sur des mesures physiques (p. ex. la National Health and Nutrition Examination Survey (NHANES) aux États‑Unis) et les comités consultatifs de l’ECMS.
Au moment de la détermination des besoins d’équipement du laboratoire du CEM, de nombreuses considérations ont été prises en compte, par exemple la taille de l’équipement (en raison des contraintes d’espace), le coût de l’équipement, l’exactitude et la précision de l’équipement de test ainsi que la comparabilité avec d’autres enquêtes internationales. La fiabilité des instruments, y compris la fréquence des pannes, les réparations et l’entretien, a aussi été examinée. Parmi les autres éléments pris en compte au moment de la sélection de l’équipement utilisé pour la collecte des données figurent les besoins d’infrastructure (p. ex. la consommation d’eau, la consommation d’énergie, l’élimination des déchets); la facilité de fonctionnement et d’entretien, y compris les cours de formation; la disponibilité et la rapidité du service partout au pays; les lignes directrices en matière de biosécurité en laboratoire; et les résultats des essais.
10.3.3.2 Protocoles et procéduresAfin de s’assurer que les employés du CEM possédaient une connaissance égale de toutes les techniques de mesure, plusieurs manuels de procédures comprenant des protocoles détaillés pour chaque mesure ont été élaborés. Ces protocoles ont été mis au point de concert avec des experts de chaque domaine de mesure, au besoin, et ont été passés en revue par eux, afin d’assurer la collecte de données de la meilleure qualité possible et les moins biaisées possibles. Aux fins de l’uniformisation, ces protocoles ont été abordés de façon approfondie au cours de la formation des employés et intégrés à l’application de saisie des données. On a exigé des employés qu’ils passent en revue ces protocoles sur une base périodique au moment de la collecte afin de maintenir leurs connaissances. Lorsque des changements ont été apportés aux protocoles, tous les employés ont été informés et ont reçu les protocoles mis à jour et la formation d’appoint appropriée, au besoin. Tous les changements apportés aux protocoles ont été documentés (date de la mise à jour, raison de la mise à jour, processus suivi).
Un manuel de vérification, d’étalonnage et d’entretien de l’équipement a aussi été rédigé pour assurer l’étalonnage et l’entretien de tout l’équipement de test au moment de la collecte, afin de respecter ou de dépasser les normes établies. Ces normes ont été établies par les fabricants d’équipement et les experts qui ont été consultés pour l’élaboration des procédures opératoires normalisées du laboratoire du clinique. Cela comprenait les fonctions préanalytiques (p. ex. les mélanges et la répartition en aliquotes), les protocoles de test (p. ex. l’hémogramme), les procédures non rattachées à des tests (p. ex. l’entreposage et l’expédition des échantillons), les procédures de contrôle de la qualité, ainsi que l’utilisation, l’étalonnage et l’entretien de l’équipement.
Les trois laboratoires de référence de l’ECMS ont aussi suivi des procédures opératoires normalisées, élaborées pour chaque test et technique exécutés dans le laboratoire. Cela a permis de disposer de protocoles d’essai uniformes que le personnel de laboratoire a utilisé pour obtenir des résultats similaires et un rendement uniforme.
10.3.3.3 Environnement du CEMTous les efforts ont été déployés pour que les mesures soient recueillies dans des conditions contrôlées et uniformisées et selon les procédures établies. Étant donné que des mesures et de l’équipement étaient très sensibles aux changements de température (p. ex. l’équipement de spirométrie, de tension artérielle et de laboratoire), tous les efforts ont été déployés pour que la température du CEM soit confortable et constante (21°C ± 2°C). Les conditions environnementales des salles de test du CEM (température, humidité et pression barométrique) ont été enregistrées au moins une fois par poste de travail, ainsi que chaque fois que la température a varié de plus de ± 2°C. Par ailleurs, on a procédé à un contrôle minitieux des conditions dans le laboratoire du CEM afin de veiller à ce que la collecte, l’analyse, l’entreposage et l’expédition des échantillons prélevés soient effectués dans les conditions appropriées.
10.3.3.4 Respect des lignes directrices à suivre avant les testsAu début de la visite au CEM, on a vérifié le respect des lignes directrices à suivre avant les tests (voir l’annexe 1) et on l’a documenté dans l’application de saisie des données; les taux de conformité ont été évalués au bureau central. Ces lignes directrices visaient à assurer la normalisation des tests, grâce à la réduction de la possibilité que des facteurs externes aient des répercussions sur les résultats de certains tests. On a procédé à une uniformisation avant les tests pour améliorer la qualité des données recueillies.
10.3.3.5 Contrôle de l’équipementOn a procédé à des vérifications, à un étalonnage et à un entretien régulier de tout l’équipement utilisé pour la collecte des données au cours de l’ECMS afin d’assurer l’exactitude et la validité des données. Ces tests ont été effectués pour respecter ou dépasser les normes établies par les fabricants de l’équipement et/ou par les experts du domaine.
10.3.3.6 Vérification de l’entrée des donnéesTous les formulaires sur papier, comme la fiche de vérification du répondant, le formulaire de consentement, le Q‑AAP, ainsi que les feuilles de travail des visites à domicile ou des visites au CEM, ont fait l’objet d’une entrée manuelle et d’une vérification subséquente par un gestionnaire, afin d’assurer l’exactitude des données entrées.
10.3.3.7 Examen des données de la spirométrieTous les tests de spirométrie ont été passés en revue par un examinateur externe au moyen d’une application personnalisée qui a été élaborée pour l’ECMS. L’application a été conçue pour rejeter les courbes invalides, selon les critères d’essai de l’American Thoracic Society11, et le rôle de l’examinateur a consisté à confirmer ces rejets, ainsi qu’à en déceler d’autres non détectés par l’application.
10.3.3.8 Validation des donnéesOn a procédé à la validation des données pour s’assurer que les données de l’ECMS étaient uniformes avec celles d’autres sources de données similaires, y compris d’autres enquêtes de Statistique Canada ainsi que des enquêtes internationales. On a procédé à la validation des données pour comparer diverses mesures physiques, mesures de laboratoire et données sur la santé bucco‑dentaire selon le site et pour comparer les données autodéclarées dans les interviews auprès des ménages aux données directement mesurées au cours de la visite au CEM (p. ex. taille, poids), selon le site et globalement. Les données sur les mesures physiques et la santé bucco‑dentaire ont aussi été comparées à d’autres sources de données comprenant des données mesurées directement, par exemple le cycle 2.2. de l’ESCC (mesures physiques seulement) et la NHANES aux États‑Unis.
Toutes les données des hémogrammes reçues du CEM ont fait l’objet d’un contrôle en comparant des valeurs moyennes et des écarts‑types à une fourchette de référence normale, cela afin de déterminer l’augmentation de valeurs aberrantes et l’accentuation de tendances dans les résultats du CQ et ceux des répondants. Les mesures de laboratoire analysées par les laboratoires de référence ont aussi fait l’objet d’un examen et d’une comparaison avec d’autres enquêtes, comme la NHANES.
Avant la diffusion des données du cycle 1, on a procédé à une validation des données externes en mettant les données à la disposition des partenaires d’enquête des autres ministères fédéraux, qui ont fait part à Statistique Canada de leurs préoccupations ou des anomalies liées à la qualité des données.
10.3.3.9 Laboratoire du centre d’examen mobile (CEM)
Des procédures ont été mises en place afin de permettre de déceler rapidement les erreurs liées aux analyses de l’hémogramme effectuées au laboratoire du CEM. Parmi ces procédures figurait le contrôle interne et externe de la qualité, qui a permis aux responsables de l’ECMS d’obtenir des résultats exacts et d’assurer la qualité des données des mesures de laboratoire. En plus du contrôle hebdomadaire, on comparait régulièrement les résultats du CQ obtenus par les autres utilisateurs de l’analyseur d’hématologie employé par l’ECMS. En outre, le matériel du CQ externe provenant du College of Americain Pathologists (CAP) et du Programme de gestion de la qualité — Service de laboratoire a été testé d’après leurs horaires respectifs. Les résultats de ces CQ à l’aveugle ont permis l’évaluation de l’exactitude des tests.
10.3.3.10 Répétition des tests
Au début des activités à chacun des sites, des échantillons répétés ont aussi été recueillis au cours des jours de l’exercice d’essai pour une gamme variée de tests de laboratoire, y compris l’hémogramme, et les tests ont été analysés dans les laboratoires de référence (Santé Canada seulement). De six à huit échantillons répétés de l’exercice d’essai ont été obtenus par suite de la répartition des échantillons de sang et d’urine des participants entre deux tubes de prélèvement distincts comportant des numéros d’identification différents. Comme les numéros d’identification correspondant aux échantillons ainsi répartis n’étaient pas connus des technologues chargés d’effectuer les tests, ces « échantillons de CQ à l’aveugle » visaient à contrôler la précision de l’analyse; on concluait qu’il y avait un problème si le coefficient de variation obtenu à partir des échantillons répétés était supérieur aux critères établis au préalable. Tous les échantillons répétés ont été envoyés aux laboratoires de référence avec les échantillons des autres répondants et ont été analysés selon les mêmes procédures que les échantillons des répondants. Les données des échantillons répétés de l’exercice d’essai ont été envoyées au bureau central pour analyse en même temps que les résultats des autres répondants, et tous les résultats se situant à l’extérieur de la limite acceptable ont fait l’objet d’un suivi auprès du laboratoire d’essai.
10.3.3.11 Vérification de la compétence
Tous les laboratoires de référence de l’ECMS devaient avoir leurs propres programmes de contrôle de la qualité. Toutefois, les responsables de l’ECMS ont aussi envoyé du matériel de référence pour le contrôle de la qualité, à titre de vérification de la compétence des laboratoires de référence. Dans le cadre de l’ECMS, on a utilisé des échantillons de contrôle BioRad dont la concentration est connue pour tous les tests compris dans l’ECMS pour lesquels des échantillons de CQ de référence étaient disponibles. L’utilisation de ce matériel a permis aux responsables de l’ECMS de contrôler l’exactitude des analyses exécutées dans les laboratoires de référence. Le laboratoire du CEM de l’ECMS a envoyé ces échantillons BioRad aux laboratoires de référence sur une base hebdomadaire pour chaque site de collecte, en même temps que les envois réguliers. Les échantillons d’essai ont été répartis en aliquotes dans les mêmes types de tubes d’expédition que ceux utilisés pour les échantillons des répondants et ont été étiquetés au moyen de numéros d’identification d’échantillon uniques, afin que le processus ne soit pas connu des laboratoires. Les résultats des tests ont été renvoyés au bureau central de l’ECMS et ont été comparés aux fourchettes de référence fournies par BioRad. Le personnel de laboratoire du bureau central a évalué les résultats des tests et a fourni de la rétroaction aux laboratoires de référence, en vue d’un examen et de mesures correctives au besoin. Des répliques ont également été effectuées au CEM pour les composantes de l’anthropométrie, de la flexion du tronc et de la force de préhension.
10.3.3.12 Traitement et entreposage des échantillons de sang et d’urine
Tous les échantillons de sang prélevés au CEM ont été traités dans les deux heures après la collecte pour en préserver la qualité et l’intégrité. Ces échantillons ont été entreposés à la température appropriée (c.‑à‑d. dans un réfrigérateur à une température de 2 oC à 8 oC ou dans un congélateur à une température de 18 oC ou plus). Ces températures ont fait l’objet d’un contrôle constant grâce à des vérifications effectuées à chaque quart de travail et à un système d’alarme. Tous les échantillons ont été traités et entreposés au plus tard quatre heures après la collecte. Les échantillons d’urine ont été réfrigérés immédiatement après la collecte et ont ensuite été traités et entreposés à la température appropriée, le plus rapidement possible.
Comme il a été décrit ci-dessus à la section 6.5 portant sur les protocoles des mesures de laboratoire, le contrôle de la température d’expédition visait à s’assurer que seuls les échantillons dont l’intégrité est demeurée intacte ont été utilisés dans le cadre des analyses des mesures de l’ECMS.
10.3.3.14 Blancs de terrain
Afin de veiller à ce que les échantillons ne soient pas contaminés par l’environnement et les processus du laboratoire du CEM, et que toutes les mesures environnementales décelées correspondent à l’état physique du répondant, le laboratoire du CEM de l’ECMS a envoyé des blancs de terrain à l’Institut national de la santé publique du Québec (INSPQ), le laboratoire responsable d’analyser les mesures environnementales. Les blancs de terrain comprenaient une solution d’essai à blanc qui avait été testée afin de confirmer qu’elle ne contenait pas de contaminants environnementaux; ces échantillons ont été utilisés pour reproduire les processus appliqués aux échantillons des répondants pour la collecte et le traitement des mesures environnementales relatives aux échantillons de sang et d’urine. On a utilisé de l’eau déionisée comme solution d’essai à blanc pour les tests de base des mesures environnementales réalisés à partir des échantillons d’urine et pour les tests visant à déceler les métaux dans le sang. De même, des tubes de sérum bovin ont servi à la collecte des blancs de terrain pour les composantes organiques présentes dans le sang. Dans le cas des sites 12 à 15 seulement, on a utilisé de l’eau pour les blancs de terrain et tous les échantillons ont été envoyés en triple. Ces blancs ont été testés et comparés à une limite supérieure acceptable correspondant à trois fois la limite de détection dans chaque substance à analyser. Les résultats supérieurs à ces limites ont été passés en revue par le personnel du bureau central et les écarts ont fait l’objet de vérifications, de concert avec le laboratoire d’analyse et d’autres experts. Au besoin, des mesures correctives ont été prises.
10.3.3.15 Examen des données du moniteur d’activité
Un processus d’examen des données a aussi été élaboré pour épurer et traiter les données du moniteur d’activité. Le processus d’examen a été décomposé en quatre étapes distinctes : l’étape 1 comprenait le téléchargement et la sauvegarde des données des répondants, le contrôle pour qu’aucun moniteur défectueux ne soit renvoyé sur le terrain et le suivi auprès des répondants qui n’avaient pas renvoyé le moniteur; l’étape 2 a consisté à intégrer toutes les données des répondants dans un fichier SAS et à laisser de côté les données non valides/erronées (p. ex. les erreurs d’initialisation ou les données fausses); l’étape 3 a consisté à accepter uniquement les données des moniteurs qui avaient au moins une journée de port valable (au moins 10 heures de données) et à calculer l’intensité de l’activité par minute; l’étape 4 a consisté à appliquer des codes de réserve pour les données manquantes et à produire les variables dérivées.
10.3.4 Bureau central de l’ECMS
10.3.4.1 Correction du biais
L’Enquête canadienne sur les mesures de la santé a été l’objet de plusieurs niveaux de non-réponse. Premièrement, il se peut que le logement sélectionné refuse de fournir la composition du ménage. Deuxièmement, une personne sélectionnée parmi les membres du ménage peut refuser de répondre au questionnaire. Troisièmement, la personne peut refuser de participer à la composante clinique. Enfin, la personne peut refuser de fournir un échantillon de sang et/ou d’urine pour les essais en laboratoire à des fins d’analyse actuelle ou future.
À chaque niveau de non-réponse, les caractéristiques dont on dispose sur les répondants et les non-répondants sont utilisées dans un modèle de régression logistique qui sert à déterminer les variables qui expliquent la plus grande partie de la non-réponse. D’après les résultats de chaque régression, des groupes homogènes de réponse sont créés. Les redressements de la non-réponse sont appliqués au sein de ces groupes.
Les variables qui présentaient la plus forte corrélation avec la réponse ou la non-réponse ont été utilisées dans les modèles de régression logistique. Elles comprenaient entre autres la région, le fait que le logement était un logement attenant ou non, l’emplacement de collecte, le groupe d’âge, le sexe, l’état matrimonial, la taille du ménage, le niveau de scolarité et le revenu.
Croyant que les personnes moins en santé étaient moins susceptibles d’aller à la clinique, les utilisateurs des données craignaient que les résultats des répondants à la composante clinique soient biaisés. On a réalisé une étude pour comparer les estimations de certaines variables du questionnaire avant et après l’ajustement de la non-réponse à la composante clinique. Les estimations fondées sur l’ensemble des répondants au questionnaire du ménage (données pondérées) ont été comparées aux estimations fondées sur les répondants à la composante clinique (données pondérées et ajustées pour la non-réponse à la composante clinique). Plusieurs variables pour les personnes ont été examinées, dont celles qui ont été utilisées dans les modèles de régression et d’autres telles que le niveau de stress, la qualité de vie, la fréquence des visites chez le dentiste, l’accès à un médecin de famille, l’usage du tabac, la consommation d’alcool, la consommation de médicaments sur ordonnance au cours du dernier mois, la situation d’emploi, la catégorie d’indice de masse corporelle et des indicateurs de la santé dont la cognition, la dextérité, les problèmes affectifs, les problèmes de l’ouïe, les niveaux d’incapacité, les troubles de mobilité, la douleur et la vision. Dans tous les cas, les différences que présentaient les variables à l’étude avant et après l’ajustement pour la non-réponse à la composante clinique étaient négligeables, ce qui donne à penser que, avec cet ajustement, les répondants à la composante clinique sont semblables aux répondants au questionnaire du ménage.
On a mené une autre étude pour comparer les adultes de 20 à 39 ans vivant avec et sans enfants âgés de 6 à 11 ans. La proportion des adultes de 20 à 39 ans vivant avec des enfants est plus élevée dans l’échantillon de l’ECMS qu’elle ne l’est au sein de la population canadienne. Ce déséquilibre découle de la sélection de deux personnes dans les ménages où un enfant de 6 à 11 ans est présent. Lorsqu’un enfant de 6 à 11 ans est sélectionné, une deuxième personne âgée de 12 à 79 ans est également sélectionnée. La deuxième personne sélectionnée est habituellement un parent se trouvant dans la fourchette d’âge de 20 à 39 ans. Par conséquent, un nombre limité d’adultes de 20 à 39 ans ne vivant pas avec des enfants de 6 à 11 ans sont sélectionnés. Comme l’étape de poststratification ne permettait pas de distinguer entre les deux types d’adultes de 20 à 39 ans, il se pourrait que la méthode de sélection ait introduit un biais. Pour évaluer ce biais possible, on a calculé le ratio des adultes de 20 à 39 ans ayant des enfants de 6 à 11 ans à ceux n’en ayant pas en utilisant la base de sondage relative aux logements des 15 emplacements (et la composition du ménage). Une poststratification a été effectuée d’après le ratio observé. Des estimations ont été produites en fonction de ces nouveaux poids, puis elles ont été comparées aux estimations initiales. Les nouvelles estimations n’étaient pas statistiquement différentes des estimations initiales. Il se peut que le nombre d’adultes de 20 à 39 ans qui vivent avec des enfants soit surestimé dans l’ECMS, mais pas au point d’introduire un biais dans les résultats globaux.
11. Lignes directrices pour la totalisation, l’analyse et la diffusion
Cette section du guide décrit les lignes directrices que doivent appliquer les utilisateurs des données qui totalisent, analysent, publient ou diffusent de quelque autre façon des données provenant des fichiers de l’enquête.
11.1 Lignes directrices pour l’arrondissement
Afin que les estimations calculées d’après ces fichiers de données en vue d’être publiées ou diffusées de toute autre façon correspondent à celles produites par Statistique Canada, il est vivement conseillé aux utilisateurs de les arrondir en se conformant aux lignes directrices concernant l’arrondissement de telles estimations.
-
Les estimations qui figurent dans le corps d’un tableau statistique doivent être arrondies à la centaine près par la méthode d’arrondissement classique. Selon cette méthode, si le premier ou le seul chiffre à supprimer se situe entre 0 et 4, le dernier chiffre retenu ne change pas. Si le premier ou le seul chiffre à supprimer se situe entre 5 et 9, on augmente d’une unité (1) la valeur du dernier chiffre retenu. Par exemple, si l’on veut arrondir à la centaine près de la façon classique une estimation dont les deux derniers chiffres sont compris entre 00 et 49, il faut les remplacer par 00 et ne pas modifier le chiffre précédent (le chiffre des centaines). Si les deux derniers chiffres sont compris entre 50 et 99, il faut les remplacer par 00 et augmenter d’une unité (1) le chiffre précédent.
-
Les sous-totaux et totaux marginaux des tableaux statistiques doivent être calculés à partir de leurs éléments correspondants non arrondis, puis arrondis à leur tour à la centaine près selon la méthode d’arrondissement classique.
-
Les moyennes, les proportions, les taux et les pourcentages doivent être calculés à partir d’éléments non arrondis (c’est-à-dire les numérateurs et/ou dénominateurs), puis arrondis à une décimale selon la méthode d’arrondissement classique.
-
Les sommes et les différences d’agrégats (ou de ratios) doivent être calculées à partir de leurs éléments correspondants non arrondis, puis arrondies à leur tour à la centaine près (ou à la décimale près) selon la méthode d’arrondissement classique.
-
Si, en raison de contraintes d’ordre technique ou autre, on applique une autre méthode que l’arrondissement classique, si bien que les estimations qui seront publiées ou diffusées de toute autre façon diffèrent des estimations correspondantes publiées par Statistique Canada, il est vivement conseillé à l’utilisateur d’indiquer la raison de ces divergences dans le ou les documents à publier ou à diffuser.
-
Des estimations non arrondies ne doivent être publiées ou diffusées de toute autre façon en aucune circonstance. Des estimations non arrondies donnent l’impression d’être beaucoup plus précises qu’elles ne le sont en réalité.
11.2 Lignes directrices pour la pondération de l’échantillon en vue de la totalisation
Le plan d’échantillonnage utilisé dans le cadre de cette enquête n’est pas autopondéré. Autrement dit, le poids d’échantillonnage n’est pas le même pour toutes les personnes qui font partie de l’échantillon. Même pour produire des estimations simples, y compris des tableaux statistiques ordinaires, l’utilisateur doit employer le poids d’échantillonnage approprié. Sinon, les estimations calculées à partir du fichier de microdonnées ne pourront être considérées comme représentatives de la population observée et ne correspondront pas à celles de Statistique Canada.
L’utilisateur ne doit pas non plus perdre de vue qu’en raison du traitement réservé au champ du poids, certains progiciels ne permettent pas d’obtenir des estimations qui coïncident exactement avec celles de Statistique Canada.
11.3 Variances ou coefficients de variation exacts
Le calcul de variances ou de coefficients de variation exacts n’est pas chose évidente puisqu’il n’existe pas de formule mathématique simple pouvant prendre en compte tous les aspects du plan d’échantillonnage et de la pondération de l’Enquête canadienne sur les mesures de la santé (ECMS). On doit donc avoir recours à d’autres méthodes pour estimer ces mesures de précisions, telles que des méthodes par rééchantillonnage. Parmi celles-ci, la méthode du bootstrap est celle recommandée pour l’analyse des données de l’ECMS.
Le calcul de coefficients de variation (ou de toute autre mesure de précision) fait à l’aide de la méthode du bootstrap nécessite toutefois l’accès à de l’information considérée confidentielle qui n’est présente que sur le fichier maître.
Pour le calcul de coefficients de variation, il est conseillé d’utiliser la méthode du bootstrap. Un programme macro, appelé « Bootvar », a été développé pour faciliter le calcul à l’aide de la méthode du bootstrap. Le programme Bootvar est offert en formats SAS et SPSS et est constitué de macros permettant de calculer les variances de totaux, de ratios, de différences entre ratios, et d’effectuer des régressions linéaires et logistiques.
Toutefois, comme les moyennes géométriques ne peuvent être calculées à l'aide de BOOTVAR, d'autres progiciels statistiques tels que SUDAAN doivent être utilisés. Comme les programmes SUDAAN et BOOTVAR utilisent des méthodes différentes pour calculer la variance, si on utilise le programme SUDAAN pour reproduire les tableaux produits à l'aide de BOOTVAR (ou l'inverse), les estimations de variance risquent d'être légèrement différentes.
11.4 Quelques recommandations pour l’analyse des données du cycle 1 de l’ECMS
L’Enquête canadienne sur les mesures de la santé (ECMS) a été conçue afin de fournir des estimations nationales de référence de la prévalence de divers indicateurs de la santé. Pour des raisons budgétaires, quinze emplacements de collecte des données ont été choisis parmi cinq strates régionales, à savoir un emplacement dans la région de l’Atlantique, quatre emplacements dans la région du Québec, six emplacements dans la région de l’Ontario, deux emplacements dans la région des Prairies et deux emplacements dans la région de la Colombie‑Britannique. Ensuite, un échantillon de personnes de tous âges a été sélectionné à chaque emplacement choisi. Ce plan de sondage devrait produire des estimations nationales de prévalence approximativement sans biais dont le c.v. est de 16,5 % environ pour une prévalence de 10 % pour chacun des cinq groupes d’âge observés (6 à 11 ans, 12 à 19 ans, 20 à 39 ans, 40 à 59 ans et 60 à 79 ans) selon le sexe.
Bien que le petit nombre d’emplacements de collecte échantillonnés permette de produire des estimations de référence de la prévalence qui satisfont aux critères susmentionnés, il a l’inconvénient de ne laisser que onze « degrés de liberté12 » pour l’estimation de la variance. Un nombre limité de degrés de liberté a plusieurs conséquences pour l’analyse et l’inférence13, en particulier les suivantes :
- la variabilité des estimations de la variance des quantités estimées doit être prise en compte dans les analyses;
- les matrices de covariance estimées des vecteurs d’estimations (tels que le vecteur des coefficients estimés d’un modèle) pourraient être singulières ou presque singulières, donc éventuellement non inversibles14;
- certaines statistiques de test pourraient être impossibles à calculer;
- les lois asymptotiques habituelles de nombreuses statistiques de test pourraient ne pas être vérifiées lorsque le nombre d’unités primaires d’échantillonnage (UPE, ici les emplacements de collecte) dans l’échantillon est faible, même si la taille totale d’échantillon est grande.
Étant donné les conséquences éventuelles d’un petit nombre d’UPE, il est conseillé aux chercheurs de prendre en considération les recommandations qui suivent durant l’analyse des données de l’ECMS :
- produire uniquement des estimations nationales, puisque le nombre de degrés de liberté sera encore plus petit que onze pour les estimations régionales, à cause du nombre plus faible d’UPE intervenant dans l’estimation de la variance. Cela permet encore d’effectuer des analyses portant sur de nombreuses sous‑populations, telles qu’un seul groupe d’âge ou l’un des deux sexes, puisque pour chaque emplacement de collecte, l’échantillon englobe tous les âges et les deux sexes;
- éviter d’ajuster des modèles comprenant un grand nombre de coefficients;
- utiliser des méthodes d’analyse qui sont moins influencées par le nombre limité de degrés de liberté ou qui sont prudentes. En particulier, lors d'un test d'hypothèse avec un vecteur de quantités, éviter d'utiliser les statistiques de Wald ou leurs dérivées puisqu'on a démontré qu'elles sont instables. De meilleurs choix seraient des statistiques ajustées de Satterthwaite ou des tests conservateurs de Bonferroni.
- Puisque des poids bootstrap sont utilisés pour l'estimation de la variance de l'ECMS, il sera probablement nécessaire d'indiquer le nombre de degrés de liberté au logiciel, puisque la valeur par défaut sera probablement incorrecte.
12. Utilisation des fichiers
12.1 Utilisation d’une variable de pondération
L’Enquête canadienne sur les mesures de la santé (ECMS) est une enquête sur échantillon, ce qui signifie que les répondants « représentent » de nombreux autres Canadiens non inclus dans l’enquête. Par exemple, un échantillon de 1 % signifierait que chaque répondant à l’ECMS représente 100 autres Canadiens. Afin que les résultats de l’enquête soient représentatifs de la population, les méthodologistes de l’ECMS ont créé des poids. Ces poids, lorsqu’ils sont appliqués aux résultats de l’enquête, permettent aux utilisateurs des données de créer des estimations pour l’ensemble de la population.
Chaque répondant compris dans le fichier maître comporte un poids unique. Afin de produire des estimations pour une caractéristique particulière, l’utilisateur des données doit faire la somme des poids de chaque répondant comportant cette caractéristique. Le total de ce calcul produira une estimation de cette caractéristique pour la population totale.
Du fait de la petite taille de l’échantillon du cycle 1 de l’ECMS, les résultats devraient être utilisés uniquement pour produire des estimations nationales. En raison du nombre différent de répondants compris dans les divers fichiers produits pour le cycle 1, chaque fichier produit comprendra une variable de pondération différente. Si des fichiers de sous‑échantillon sont couplés au fichier maître, le poids compris dans le fichier maître devrait être utilisé pour la création des estimations.
12.2 Fichier d’Environnement Canada sur le climat et la qualité de l’air
L’une des composantes du questionnaire de la partie clinique de l’ECMS porte sur la spirométrie, laquelle permet de mesurer la fonction respiratoire. Puisque l’atmosphère peut avoir un effet sur la fonction respiratoire, les chercheurs peuvent devoir ajuster les résultats en fonction du temps qu’il faisait et de la qualité de l’air au moment de la visite au CEM lorsqu’ils analyseront les données de la composante de la spirométrie. Dans le but de répondre à cette nécessité, un fichier contenant des données sur le climat et la qualité de l’air pour chaque heure a été créé pour toutes les dates où l’on a recueilli des données au CEM, et ce, pour chacun des 15 sites. Les données ont été obtenues auprès des Archives nationales d’information et de données climatologiques (www.climate.weatheroffice.gc.ca) et du Réseau national de surveillance de la pollution atmosphérique (http://etc-cte.ec.gc.ca/NAPS/).
Les indicateurs suivants se trouvent dans le fichier sur le climat et la qualité de l’air :
Qualité de l’air : ozone, dioxyde d’azote, matière particulaire (2,5 microns)
Climat : température, pression barométrique, précipitations, humidité relative, humidex, vitesse du vent, direction du vent, refroidissement éolien
De la documentation complémentaire à propos de ce fichier est disponible sur demande.
12.3 Convention appliquée pour nommer les variables
La convention de désignation de l’ECMS suit le même modèle que celui utilisé pour l’Enquête sur la santé dans les collectivités canadiennes (ESCC) et, en fait, de nombreuses enquêtes de Statistique Canada. Le nom de la variable est établi de façon à permettre aux utilisateurs des données de déterminer facilement la section d’origine de l’enquête, le type de variable et la question d’enquête qui a servi à recueillir les données. Les noms des variables ont aussi été créés de façon à pouvoir déceler les données similaires dans les différents cycles de l’ECMS.
Chaque nom de variable doit respecter des exigences obligatoires, qui restreignent les noms de variables à un maximum de huit caractères, pour qu’il soit facile de les utiliser dans les logiciels d’analyse. Par conséquent, chaque caractère du nom de la variable comprend des renseignements concernant les données comprises dans la variable.
De façon générale :
Positions 1 à 3 : Nom de la section
Position 4 : « _ » ou type de variable
Positions 5 à 8 : Renvoi à la question
Par exemple : La variable de la question 101 de la section sur les problèmes de santé chroniques du questionnaire auprès des ménages, CCC_101 :
Positions 1 à 3 : Section des problèmes de santé chroniques CCC
Position 4 : _ trait de soulignement (_ = données recueillies)
Positions 5 à 7 : question numéro 101
On se sert des valeurs suivantes pour la composante du nom de la variable correspondant à la section du questionnaire :
| Sujet | Variable |
|---|---|
Activités physiques |
PAC |
Activités physiques des enfants |
CPA |
Activités sédentaires |
SAC |
Allaitement maternel |
MBF |
Antécédents médicaux familiaux |
FMH |
Biphényles polybromés (PBB) |
PBB |
biphényles polychlorés (BPC) |
PCB |
Caractéristiques du logement |
HSC |
Caractéristiques sociodémographiques |
SDC |
Changement de poids |
WTC |
Clinique - Général
|
SITE |
V2 |
|
Collecte d’un échantillon d’urine |
URC |
Comportement sexuel |
SXB |
Consentement |
CON |
Consommation d’alcool |
ALC |
Consommation d’eau et de boissons gazeuses |
WSD |
Consommation de céréales, de fruits et de légumes |
GFV |
Consommation de drogues illicites |
IDU |
Consommation de lait et de produits laitiers |
MDC |
Consommation de matières grasses alimentaires |
DFC |
Consommation de médicaments |
AHF |
ATC |
|
MED |
|
Consommation de sel |
SLT |
Consommation de viande et de poisson |
MFC |
Éducation |
EDU |
État de jeûne |
ATG |
État de santé général |
GEN |
Éthers diphényliques polybromés (PBDE) |
PBD |
Exposition à la fumée des autres |
ETS |
Exposition au soleil |
SEB |
Flexion du tronc |
SRM |
Flexion du tronc – Admissibilité |
SRC |
Force de préhension |
GSM |
Force de préhension – Admissibilité |
GSC |
Formule sanguine/ hémogramme |
CBC |
Grossesse |
PRS |
Hépatite |
HEP |
Indice de l’état de santé |
HUI |
Information sur l’accouchement |
BIR |
Information sur l’allaitement |
BRI |
Information sur la grossesse |
PRG |
Mesures anthropométriques |
HWM |
Mesures anthropométriques – Admissibilité |
ANC |
Mesures anthropométriques– mesures du plis cutané |
SFM |
| Moniteur d’activité variables dérivée – Fichier maître | AMM |
| Moniteur d’activité variables dérivée – Fichier de sous-échantillon (4+ jours) | AMS |
Passe-temps |
HOB |
Personne fournissant linformation |
PPI |
Phlébotomie |
BDC |
Phlébotomie – Admissibilité |
PHB |
Phlegme |
PLM |
Physitest aérobie canadien modifié (PACm) |
AFT |
Physitest aérobie canadien modifié (PACm) – Admissibilité |
AFC |
Points forts et difficultés |
SDQ |
Population active |
LBF |
Prélèvement de sang |
BDC |
Problèmes de santé chroniques |
CCC |
Rapport des mesures |
RMC |
Redressements assis partiels |
PCM |
Redressements assis partiels – Admissibilité |
PCC |
Revenu |
INC |
Santé bucco-dentaire |
OHE |
OHM |
|
OHQ |
|
OHR |
|
Santé bucco-dentaire – Admissibilité |
OHC |
Sélection |
ATG |
MHR |
|
ORS |
|
PAR |
|
PHC |
|
SPQ |
|
Sommeil |
SLP |
Spirométrie |
SPM |
Spirométrie – Admissibilité |
SPC |
Taille et poids |
HWT |
Tension artérielle |
BPM |
Tests de laboratoire de sang et d’urine |
LAB |
Usage du tabac |
SMK |
Utilisation de produits de toilette |
GPU |
Vaccin contre le papillomavirus |
HPV |
Variables démographiques et sur les ménages |
DHH |
Vérification du répondant |
CLC |
12.3.2 Position 4 : Remplissage ou type de variable
_ Variable recueillie : variable qui figure directement dans le questionnaire
C Variable codée : variable codée à partir d’une ou de plusieurs variables recueillies (p. ex. CTI, code de la Classification type des industries)
D Variable dérivée : variable calculée à partir d’une ou de plusieurs variables recueillies ou codées
G Variable groupée : variables recueillies, codées ou dérivées agrégées en groupes (p. ex. groupes d’âge)
12.3.3 Positions 6 à 8 : Renvoi à la questionEn général, les trois dernières positions correspondent à la numérotation de la variable qui figure dans le questionnaire. La lettre « Q » qui représentait le mot « question » est supprimée, et tous les numéros de question sont présentés au moyen de deux chiffres. Par exemple, la question Q01A du questionnaire devient simplement 01A et la question Q15, simplement 15.
Parfois, certaines questions comportent plusieurs réponses, ce qui fait que la position finale dans la séquence du nom de la variable est représentée par une lettre. Pour ce genre de questions, de nouvelles variables ont été créées dans le but de différencier un « oui » d’un « non » pour chaque option de réponse. Par exemple, si la question Q2 comporte plusieurs options de réponse, les nouvelles questions seront désignées Q2A pour l’option 1, Q2B pour l’option 2, Q2C pour l’option 3, etc. Si seulement les options 2 et 3 sont choisies, alors Q2A = Non, Q2B = Oui, Q2C = Oui et Q2D = Non.
12.4 Accès aux données du fichier maître
L’accès aux données est assuré par l’entremise des centres de données de recherche. Ces centres permettent aux chercheurs de soumettre à Statistique Canada des projets de recherche qui seront réalisés à partir des données des répondants provenant des fichiers diffusés. Un ensemble particulier de règles est appliqué afin de décider quels projets seront acceptés. Lorsque le projet est accepté, le chercheur est considéré comme une « personne réputée être employée » par Statistique Canada pour la durée de l’étude et se voit accorder l’accès aux données de l’enquête dans des locaux désignés de Statistique Canada. Pour plus de renseignements, veuillez consulter la page Web de Statistique Canada : www.statcan.gc.ca/rdc-cdr/index-fra.htm.
Une autre façon d’accéder aux données du fichier maître est de fournir à Statistique Canada les spécifications pour les totalisations. Ces tableaux sont programmés et exécutés en fonction des fichiers de données par des employés de Statistique Canada. Ce service permet aux utilisateurs qui ne savent pas se servir de logiciels de totalisations ou qui n’ont pas accès aux centres de données de recherche d’obtenir des tableaux personnalisés. Les résultats sont filtrés pour s’assurer qu’ils sont conformes aux normes de confidentialité et de fiabilité avant d’être diffusés.
12.5 Concordance des variables
Afin de faciliter l’utilisation des données du cycle 01, les noms des variables se trouvant dans le fichier maître ont été modifiés par rapport à ceux utilisés pour la collecte des données. Par contre, les questionnaires ci-joints (voir l’annexe 6) montrent les noms utilisés lors de la collecte. Un tableau de concordance des noms utilisés dans le fichier maître et des noms utilisés pour la collecte est inclus (voir l’annexe 8) afin que les utilisateurs des données puissent travailler facilement et rapidement tant avec le fichier qu’avec les questionnaires.
12.6 Notes spéciales
-
Il convient de noter que MEDF1 (une étiquette de l’ESCC qui indique si une personne a pris des médicaments au cours du dernier mois) ne figure pas dans le fichier de l’ECMS. Les utilisateurs peuvent déterminer combien de médicaments un répondant de l’ECMS a pris à partir des variables MED_100B, MED_200B et MED_300B. Ces variables indiquent le nombre de médicaments sur ordonnance, de médicaments en vente libre et de produits et remèdes à base de plantes médicinales, respectivement, qui ont été pris au cours du dernier mois.
-
Des renseignements sur l’âge et le sexe sont recueillis deux fois durant la processus d’enquête de l’ECMS, d’abord au moment de l’interview auprès des ménages, puis au moment de la composante du centre d’examen mobile (CEM). Puisque les deux rendez-vous peuvent être séparés de plusieurs jours, il est possible que l’âge du répondant soit différent dans les fichiers des ménages et du CEM. Pour chaque application, on utilise les renseignements recueillis sur l’âge et le sexe comme référence pour les modèles de couverture et d’enchaînement des questions pour les sections incluses dans l’application. Pour cette raison, il est important d’utiliser les variables appropriées de l’âge et du sexe pour les données à analyser. Une utilisation incorrecte des variables de l’âge et du sexe pourrait mener à des analyses erronées en raison du fait que l’âge de certains répondants change entre les deux rendez-vous. Par exemple, un répondant qui est âgé de 11 ans au moment de l’interview auprès des ménages et de 12 ans au moment de la visite au CEM se retrouvera dans des groupes d’âge différents selon les données analysées (c’est-à-dire dans le groupe des 6 à 11 ans pour l’analyse des données des ménages et dans celui des 12 à 19 ans pour l’analyse des données du CEM).
Pour la composante des ménages, les variables DHH_AGE et DHH_SEX doivent être utilisées; pour la composante du CEM, les variables CLC_AGE et CLC_SEX doivent être utilisées. Si des variables provenant des deux composantes sont analysées, nous suggérons d’utiliser les variables de l’âge et du sexe de la composante qui contient la variable d’intérêt la plus importante.
-
Pour aider à mettre en contexte certaines données brutes recueillies au CEM, des échelles normatives utilisées par les analystes pour des types de données précises ont été ajoutées au fichier du CEM. Les normes utilisées pour la collecte des données du cycle 01 on été adoptées au début de la collecte, et les répondants étaient informés d’où ils se classaient d’après ces normes dans le rapport final qui leur était fourni. Les normes utilisées pour l’ensemble de la collecte du cycle 01 ne reflètent pas les changements ayant pu être faits entre le début de la collecte en 2007 et aujourd’hui. Comme les données brutes sont aussi incluses dans le fichier, les utilisateurs peuvent utiliser d’autres normes que celles qui y sont fournies.
-
Il est important de noter que les tests de laboratoire suivants comportaient des limites concernant la stabilité
Homocystéine :
L’homocystéine est sensible au temps et à la température. Le protocole du CEM demandait à ce que les échantillons soient traités et entreposés dans un laps de temps de quatre heures après le prélèvement. De façon générale, cependant, il s’écoulait pour ce test moins de une heure et demie après le prélèvement de sang pour la répartition en aliquotes et l’entreposage.
Bilirubine :
Aux deux tiers de l’enquête, des mesures ont été prises pour préserver l’intégrité des échantillons pour l’analyse de la bilirubine. Des changements ont été apportés pour protéger les échantillons de la lumière en tout temps durant la collecte, le traitement et l’entreposage. Une modification des résultats pourrait être observée.
Bicarbonate :
Le bicarbonate est sensible au temps puisque sa concentration peut diminuer avec le temps à cause de la perte de CO2. Idéalement, le bicarbonate devrait être analysé dans les 3 jours suivant le prélèvement. Le bicarbonate fait partie de la batterie d’analyses chimiques qui étaient réfrigérées et envoyées une fois par semaine au laboratoire de référence. Étant donné que certains de ces échantillons pouvaient avoir été entreposés depuis 8 jours, il se peut que cela ait eu un effet sur cette mesure. -
Pendant l'interview à domicile, les répondants sont priés de nommer les médicaments sur ordonnance et en vente libre ainsi que les remèdes à base de plantes médicinales qu'ils prennent. Au moment de l'interview à la clinique, on leur demande de préciser s’ils prennent encore le ou les médicaments qu'ils ont nommés lors de l'interview à domicile ainsi que de nommer tous les nouveaux médicaments qu'ils ont commencé à prendre depuis ce temps. Cinq médicaments supplémentaires au plus peuvent être inscrits dans chaque catégorie (médicaments sur ordonnance, médicaments en vente libre et remèdes à base de plantes médicinales). Si le répondant indique plus de cinq nouveaux médicaments dans une catégorie donnée, seuls les cinq premiers sont retenus et codés.
-
Système de classification anatomique thérapeutique chimique (ATC) – Le système de classification anatomique thérapeutique chimique (ATC), mis au point par l'Organisation mondiale de la santé (OMS), permet de classer les produits pharmaceutiques selon l'organe ou le système sur lequel ils agissent ainsi que selon leurs propriétés chimiques, pharmacologiques et thérapeutiques. Un code ATC a été attribué à chaque médicament à l’aide du numéro d'identification du médicament (DIN) et du système de codage ATC de Santé Canada. Lorsque le médicament a plus d’une indication, le code ATC est établi en fonction de la principale indication. Celle‑ci est déterminée par les examinateurs de Santé Canada à l'aide de la monographie du produit (document factuel sur le médicament décrivant les propriétés, les effets allégués, les indications et le mode d’emploi propres au médicament). Lorsque la monographie du produit ne permettait pas d’établir avec certitude le code ATC à attribuer, un représentant de Santé Canada se mettait en rapport avec le Collaborating Centre for Drug Statistics Methodology de l’OMS, en Norvège, pour obtenir des éclaircissements. Aucun code ATC n'était attribué à un médicament si le DIN était manquant ou s'il n'y avait pas de DIN dans la base de données de Santé Canada sur les médicaments (pour les médicaments expérimentaux, par exemple). Dans ces cas, la mention « non déclarée » figure dans le fichier. Le système de classification n'existe qu'en anglais. Pour plus de renseignements sur le système de classification ATC, prière de consulter le site www.whocc.no/atc_ddd_index/.
-
Système de classification de l'American Hospital Formulary Service (AHFS) – Le système de classification de l'American Hospital Formulary Service (AHFS) est publié par l'American Society of Health‑System Pharmacists afin de décrire le mode d'action des produits pharmaceutiques, y compris les suppléments vitaminiques et minéraux. Le système de classification n'existe qu'en anglais. Pour plus de renseignements sur le système de classification de l'AHFS, prière de consulter le site www.ahfsdruginformation.com/.
- Teneur en goudron – Le teneur en goudron a été fourni par la Santé Canada et été déterminé comme suivant :
-
Cinq cigarettes conditionnées sont fumées mécaniquement sur chacun des canaux d’une machine à fumer linéaire automatisée, à 20 canaux et à volume constant, équipée d’un analyseur de CO et d’un disque filtrant (tampon-filtre) en fibre de verre conditionné et pré-pesé. La phase gazeuse est prélevée dans un sac à gaz, puis introduite dans un analyseur infrarouge non dispersif (IRND) qui détermine la concentration (en %) de CO. Le tampon est pesé; la différence de poids correspond à la matière particulaire totale (MPT). On extrait le tampon avec de l’isopropanol auquel les étalons internes ont été ajoutés, puis on dose la nicotine et l’eau dans l’extrait par chromatographie en phase gazeuse (CG). On détermine la teneur en goudron en soustrayant la teneur en eau et en nicotine de la teneur en MPT.15
-
Cinq cigarettes conditionnées sont fumées mécaniquement sur chacun des canaux d’une machine à fumer linéaire automatisée, à 20 canaux et à volume constant, équipée d’un analyseur de CO et d’un disque filtrant (tampon-filtre) en fibre de verre conditionné et pré-pesé. La phase gazeuse est prélevée dans un sac à gaz, puis introduite dans un analyseur infrarouge non dispersif (IRND) qui détermine la concentration (en %) de CO. Le tampon est pesé; la différence de poids correspond à la matière particulaire totale (MPT). On extrait le tampon avec de l’isopropanol auquel les étalons internes ont été ajoutés, puis on dose la nicotine et l’eau dans l’extrait par chromatographie en phase gazeuse (CG). On détermine la teneur en goudron en soustrayant la teneur en eau et en nicotine de la teneur en MPT.15
- Note aux utilisateurs – les métabolites de phtalates:
Les données sur les métabolites de phtalates de l’Enquête canadienne sur les mesures de la santé (ECMS) ont été ajustées pour corriger un biais causé par l’inexactitude des étalons utilisés lors de la calibration des instruments analytiques et pour permettre la comparaison des données de l’ECMS d’un cycle à l’autre de l’enquête. Les facteurs d’ajustement ont été déterminés à partir de la différence d’exactitude entre les étalons ayant servi à l’analyse des échantillons et ceux considérés comme exacts. L’application de ces facteurs d’ajustement fait présentement l’objet d’un examen par les pairs.
13. Références et notes
-
Strate définie selon la composition du ménage au Recensement de 2006.
-
On a augmenté le facteur multiplicatif de 3 à 5 lors du déroulement de la collecte pour le groupe d’âge des 12 à 19 ans pour les strates 6 à 11 ans, 12 à 19 ans et autres afin d’atteindre le nombre de répondants cibles pour ce groupe d’âge.
-
Société canadienne de physiologie de l’exercice, 2004, Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller CPHV), 3e édition, Ottawa.
-
Ross, W. D. & M.J. Marfell-Jones. 1991.« Kinanthropometry » in Physiological Testing of the High-Performance Athlete, 2ième édition,. J. D. MacDougall, H. A. Wenger, & H. J. Green, eds., Human Kinetics Books, Champaign, Illinois, pp. 223-308.
-
Condition physique et Sport amateur Canada. 1986. Physimonoxyde de carbonetest normalisé canadien (PNC), Manuel technique, troisième édition. Ottawa.
-
Campbell, Norm R.C., Joffre Michel R., McKayDonald W. 2005. « Hypertension Surveillance in Canada: Minimum Standards for Assessing Blood Pressure in Surveys. » Canadian Journal of Public Health. Vol. 96, no 3, pp. 217-220.
-
Miller M.R., J. Hankinson, V. Brusasco et al. 2005. « Standardization of spirometry » Eur Respir, Vol. 26, pp. 319-338.
-
Les cinq limites régionales types sont : la Colombie-Britannique, les Prairies (Alberta, Manitoba et Saskatchewan), l’Ontario, le Québec et les provinces de l’Atlantique (Terre-Neuve-et-Labrador, Île-du-Prince-Édouard, Nouvelle-Écosse et Nouveau-Brunswick).
-
Le nombre de sites sélectionnés pour chaque LRT est donné dans le tableau 5.1 de la section 5.3.1 Échantillonnage des sites de collecte du chapitre 5. Plan d’échantillonnage.
-
Parmi les logements sélectionnés au départ, certains ne font pas partie du champ de l’enquête. Ce sont par exemple des logements vacants ou démolis, des logements non résidentiels ou encore des logements dont tous les membres du ménage sont âgés de moins de 6 ans, de plus de 79 ans ou sont membres à temps plein des Forces canadiennes, Ces logements sont identifiés pendant la collecte, autrement ils auraient été exclus lors de la sélection. Ces logements ne sont pas considérés dans le calcul des taux de réponse.
-
American Thoracic Society. 1995. « Standardization of Spirometry 1994 Update. » Am J Respir Crit Care Med, Vol. 152, pp. 1107-1136.
-
L’expression « degrés de liberté » est utilisée comme un terme générique qui reflète la quantité d’information utilisée pour estimer les variances et les covariances. Une approximation souvent utilisée pour déterminer le nombre de « degrés de liberté » est (nbre d’UPE - nbre de strates). Dans le cas de l’ECMS, les emplacements de collecte (15) sont les UPE. Pour l’estimation de la variance, l’UPE unique correspondant à la région de l’Atlantique est regroupée avec les quatre UPE de la région du Québec, ce qui laisse quatre strates et un nombre de « degrés de liberté » égal à (15 4) = 11.
-
En particulier, les intervalles de confiance et les tests d’hypothèse.
-
Des matrices de covariance inversibles sont nécessaires pour appliquer les tests de Wald aux vecteurs de paramètres.
- Santé Canada. 1999. Dosage du « goudron », de la nicotine et du dans la fumée principale de tabac. Ottawa
Annexe 1 : Lignes directrices à suivre avant les tests
Lignes directrices à suivre avant les tests pour les rendez‑vous le matin>
Lignes directrices à suivre
- Vous ne devez pas :
- Consommer des aliments ou des boissons, à l’exception de l’eau, durant les 12 heures qui précèdent votre rendez‑vous à la clinique – par exemple, vous ne devez pas manger de bonbons, de pastilles pour la toux, de gomme à mâcher ou boire de l’eau aromatisée au cours de la période à jeun.
- Fumer ou consommer d’autres produits de tabac et de nicotine durant les 2 heures qui précèdent votre rendez‑vous à la clinique.
- Consommer des boissons alcoolisées durant les 12 heures qui précèdent votre rendez‑vous à la clinique.
- Faire de l’exercice physique le jour de votre rendez‑vous à la clinique à partir de minuit).
- Donner du sang 2 jours avant votre rendez‑vous à la clinique.
- Porter des produits parfumés le jour de votre rendez‑vous à la clinique.
- Veuillez apporter des vêtements amples (p. ex., un short, un pantalon de survêtement, un haut à manches courtes), des chaussures appropriées pour faire de l’exercice (p. ex., des souliers de marche ou de course) et votre carte d’assurance‑maladie.
- Consommation de médicaments :
- Prenez vos médicaments comme d’habitude le jour de votre rendez‑vous à la clinique.
- Veuilllez apporter avec vous tous les médicaments (prescrits ou en vente libre), remèdes à base de plantes médicinales ou suppléments que vous avez commencé à prendre après l’interview à domicile ou que vous n’avez pas mentionnés lors de l’interview.
- Si vous avez un problème respiratoire (p. ex., l’asthme), veuillez apporter votre inhalateur ou vos médicaments à votre rendez‑vous à la clinique.
Lignes directrices à suivre avant les tests pour les rendez‑vous l’après‑midi ou le soir
Lignes directrices à suivre
- Vous ne devez pas :
- Consommer des aliments ou des boissons, à l’exception de l’eau, durant les 2 heures qui précèdent votre rendez‑vous à la clinique – par exemple, vous ne devez pas manger de bonbons, de pastilles pour la toux, de gomme à mâcher ou boire de l’eau aromatisée au cours de la période à jeun.
- Fumer ou consommer d’autres produits de tabac et de nicotine durant les 2 heures qui précèdent votre rendez‑vous à la clinique.
- Consommer des boissons alcoolisées le jour de votre rendez‑vous à la clinique.
- Faire de l’exercice physique le jour de votre rendez‑vous à la clinique (à partir de minuit).
- Donner du sang 2 jours avant votre rendez‑vous à la clinique.
- Porter des produits parfumés le jour de votre rendez‑vous à la clinique.
- Veuillez apporter des vêtements amples (p. ex., un short, un pantalon de survêtement, un haut à manches courtes), des chaussures appropriées pour faire de l’exercice (p. ex., des souliers de marche ou de course) et votre carte d’assurance‑maladie.
- Consommation de médicaments :
- Prenez vos médicaments comme d’habitude le jour de votre rendez‑vous à la clinique.
- Veuillez apporter avec vous tous les médicaments (prescrits ou en vente libre), remèdes à base de plantes médicinales ou suppléments que vous avez commencé à prendre après l’interview à domicile ou que vous n’avez pas mentionnés lors de l’interview.
- Si vous avez un problème respiratoire (p. ex., l’asthme), veuillez apporter votre inhalateur ou vos médicaments à votre rendez‑vous à la clinique.
Annexe 2
| Mesure | Critères d’exclusion | |
|---|---|---|
| Codage fixe | Décision du personnel | |
| Tension artérielle | Aucun | Exclusion d’un test
|
| Taille en position debout | Aucun |
|
| Taille en position assise | Aucun |
|
| Poids | Aucun |
|
| Circonférence de la taille |
|
|
| Circonférence des hanches |
|
|
| Plis cutanés |
|
Exclusions pour ce pli cutané :
|
| Phlébotomie |
|
|
| Urine | Aucun |
|
| Moniteur d’activité | Aucun |
|
| Spirométrie |
|
|
| Force de préhension |
|
|
| PACm |
|
|
| Flexion du tronc |
|
|
| Redressements assis partiels |
|
|
| Santé bucco‑dentaire (exclusion de la composante de l’examen bucco-dentaire uniquement) |
|
|
Annexe 3 : Q‑AAP
Q-AAP et Vous
(Un questionnaire pour les gens de 15 à 69 ans)
L’exercice physique pratiqué d’une façon régulière constitue une occupation de loisir saine et agréable. D’ailleurs, de plus en plus de gens pratiquent une activité physique de façon régulière. Règle générale, augmenter la pratique sportive n’entraîne pas de risques de santé majeurs. Dans certains cas, il est cependant conseillé de passer un examen médical avant d’entreprendre un programme régulier d’activités physiques. Le Q-AAP (questionnaire sur l’aptitude à l’activité physique) vise à mieux cerner les personnes pour qui un examen médical est recommandé.
Si vous prévoyez modifier vos habitudes de vie pour devenir un peu plus actif(ve), commencez par répondre aux 7 questions qui suivent. Si vous êtes agé(e) de 15 à 69 ans, le Q-AAP vous indiquera si vous devez ou non consulter un médecin avant d’entreprendre votre nouveau programme d’activités. Si vous avez plus de 69 ans et ne participez pas d’une façon régulière à des activités physiques exigeantes, vous devriez consulter votre médecin avant d’entreprendre ces activités.
Lisez attentivement et répondez honnêtement à chacune des questions suivantes. Le simple bon sens sera votre meilleur guide pour répondre correctement à ces questions. Cochez Oui ou Non.
1. Votre médecin vous a-t-il déjà dit que vous souffriez d’un problème cardiaque et que vous ne deviez participer qu’aux activités physiques prescrites et approuvées par un médecin?
- Oui
- Non
2. Ressentez-vous une douleur à la poitrine lorsque vous faites de l’activité physique?
- Oui
- Non
3. Au cours du dernier mois, avez-vous ressenti des douleurs à la poitrine lors de périodes autres que celles où vous participiez à une activité physique?
- Oui
- Non
4. Éprouvez-vous des problèmes d’équilibre reliés à un étourdissement ou vous arrive-t-il de perdre connaissance?
- Oui
- Non
5. Avez-vous des problèmes osseux ou articulaires (par exemple, au dos, au genou ou à la hanche) qui pourraient s’aggraver par une modification de votre niveau de participation à une activité physique?
- Oui
- Non
6. Des médicaments vous sont-ils actuellement prescrits pour contrôler votre tension artérielle ou un problème cardiaque (par exemple, des diurétiques)?
- Oui
- Non
7. Connaissez-vous une autre raison pour laquelle vous ne devriez pas faire de l’activité physique?
- Oui
- Non
Si vous avez répondu OUI à une ou plusieurs questions
Consultez votre médecin AVANT d’augmenter votre niveau de participation à une activité physique et AVANT de faire évaluer votre condition physique. Dites à votre médecin que vous complété le questionnaire sur l’aptitude à l’activité physique et expliquez-lui précisément à quelles questions vous avez répondu OUI.
- Il se peut que vous n’ayez aucune contre-indication à l’activité physique dans la mesure où vous y allez lentement et progressivement. Par ailleurs, il est possible que vous ne puissez faire que certains types d’efforts adaptés à votre état de santé. Indiquez à votre médecin le type d’activité physique que vous comptiez faire et suivez ses recommandations.
- Informez-vous quant aux programmes d’activités spécialisés les mieux adaptés à vos besoins, offerts dans votre localité.
NON à toutes ces questions:
Remettre à plus tard l’augmentation de votre participation active :
- si vous souffrez présentement de fièvre, d’une grippe ou d’une autre affection passagère attendez d’être remis(e); ou
- si vous êtes enceinte ou croyez l’être, consultez votre médecin avant de modifier votre niveau de pratique sportive régulière.
Veuillez noter que si votre état de santé se trouve modifié de sorte que vous deviez répondre OUI à l’une ou l’autre des questions précédentes, consultez un professionnel de la santé ou de la condition physique, afin de déterminer s’il vous faut modifier votre programme d’activités.
Formule de consentement du Q-AAP : La Société canadienne de physiologie de l’exercice, Santé Canada et ses représentants n’assument aucune responsabilité vis-à-vis des accidents qui pourraient survenir lors de l’activité physique. Si, après avoir complété le questionnaire ci-dessus, un doute persiste quant à votre aptitude à faire une activité physique, consultez votre médecin avant de vous y engager.
Toute modification est interdite. Nous vous encourageons à copier le Q-AAP dans sa totalité.
Dans le mesure où le Q-AAP est administré avant que la personne s’engage dans un programme d’activités ou qu’elle fasse évaluer sa condition physique, la section suivante constitue un document ayant une valeur légale et administrative.
«le sous-signé(e) affirme avoir lu, compris et complété le questionnaire et avoir reçu une réponse satisfaisante à chacune de mes questions»
- Nom
- Signature
- Date
- Signature d'un parent Ou tuteur (pour les mineurs)
- témoin
N.B. – Cette autorisation de faire de l’activité physique est valide pour une période maximale de 12 mois à compter du moment où le questionnaire est rempli. Elle n’est plus valide si votre état de santé change de telle sorte que vous répondez OUI à l’une des sept questions.
Aux professionnels de la condition physique et de la santé :
Les formulaires complémentaires suivants sont aussi disponibles. Veuillez consulter notre site web à l’adresse : http://www.csep.ca/formulaires.asp.
L’Évaluation médicale de l’aptitude à l’activité physique (PARmed-X). Formulaire conçu pour le médecin de la personne ayant répondu ”OUI” à au moins une des questions du Q-AAP.
L’Évaluation médicale de l’aptitude à l’activité physique pour la grossesse (PARmed-X pour femmes enceintes). Formulaire conçu pour le médecin dont les patientes enceintes veulent faire de l’activité physique.
Références:
Risk Assessment of Physical Activity and Physical Fitness in the Canada Health Survey Follow-Up Study. J. Clin. Epidemiol. 45:4 419-428.
Mottola, M., Wolfe, L.A. (1994). Active Living and Pregnancy, In: A. Quinney, L. Gauvin, T. Wall (eds.), Toward Active Living: Proceedings of the International Conference on Physical Activity, Fitness and Health. Champaign, IL: Human Kinetics.
PAR-Q Validation Report, British Columbia Ministry of Health, 1978.
Thomas, S., Reading, J., Shephard, R.J. (1992). Revision of the Physical Activity Readiness Questionnaire (PAR-Q). Can. J. Spt. Sci. 17:4 338-345.
Pour télécharger le copies additionnels, veuillez consulter notre site web:
http://www.csep.ca/formulaires.asp. Pour plus d’informations veuillez contacter la :
Société canadienne de physiologie de l’exercice
202-185 rue Somerset Ouest
Ottawa (Ontario) Canada K2P 0J2
Tél. (sans frais) 1-877-651-3755
Téléc. (613) 234-3565
Site web: www.csep.ca
Le Q-AAP original a été conçu par le ministère de la Santé de la Colombie-Britannique. Il a été révisé par les membres d’un Comité consultatif d’experts de la Société canadienne de physiologie de l’exercice sous la direction du Dr N. Gledhill (2002).
Available in English under the title: ”Physical Activity Readiness Questionnaire – PAR-Q and You (revised 2002)”
Annexe 4 : Protocoles du cycle 1 de l’Enquête canadienne sur les mesures de la santé (ECMS)
1. Composante anthropométrique
1.1 Taille en position debout
La taille en position debout est une évaluation de la taille verticale maximale. Cette mesure a été prise pour tous les répondants de 6 ans et plus capables de se ternir debout sans aide. La taille en position debout a été mesurée au moyen d’un stadiomètre fixe comportant une planche dorsale verticale et une équerre amovible, selon une procédure fondée sur le Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller CPHV)1.
1.1.1 Équipement
- Stadiomètre numérique ProScale M150.
1.1.2 Admissibilité
- Tous les répondants de 6 à 79 ans capables de se tenir debout sans aide.
- Répondants qui ne peuvent pas se tenir debout sans aide.
- Répondants qui souffrent d’une maladie aiguë les empêchant de subir la mesure (p. ex. jambe plâtrée qui ne leur permet pas de se tenir debout sans aide).
1.1.3 Critères d’exclusion
- Les répondants qui ne peuvent se tenir debout sans aide.
- Les répondants qui souffrent d’une maladie aiguë les empêchant de subir la mesure (p.ex., jambe plâtrée qui ne leur permet de se tenir debout sans aide).
1.1.4 Mesure de la taille
-
Le spécialiste des mesures de la santé (SMS) a demandé au répondant d’enlever ses chaussures et de déplacer ou d’enlever les décorations, bijoux, chignons ou tresses du dessus de sa tête.
-
Le répondant devait se ternir debout, les bras pendants à ses côtés et les pieds joints. Le répondant devait garder ses talons, ses fesses, son dos et sa tête appuyés contre la planche dorsale verticale du stadiomètre. Selon la forme corporelle générale du répondant, il est arrivé que tous les points ne touchaient pas la planche verticale. Dans ces cas, on s’est assuré que le tronc du répondant était à la verticale à partir de la taille et que ses bras et ses épaules étaient détendus. Le SMS s’est assuré que la masse corporelle était distribuée également et que les deux pieds étaient à plat sur le sol.
-
Le SMS a demandé au répondant de regarder droit devant lui. La tête du répondant était alignée en fonction du plan de Frankfort. La tête se trouve dans le plan de Frankfort lorsque la ligne horizontale qui va du conduit auditif jusqu’au bord inférieur de l’orbite de l’œil est parallèle au sol et perpendiculaire à la planche dorsale verticale. Au besoin, le SMS a déplacé doucement la tête du répondant vers le haut ou vers le bas jusqu’à ce que l’alignement approprié soit atteint, pendant que le regard du répondant se portait droit devant.
Nota : Si un répondant ne pouvait pas garder sa tête en contact avec le stadiomètre lorsqu’il était dans la position du plan de Frankfort, c’est la position du plan de Frankfort qui a eu préséance sur le contact du derrière de la tête avec le stadiomètre.
- Le répondant devait se tenir le plus droit possible, respirer profondément et retenir son souffle pendant la prise de la mesure. Une inspiration profonde redresse la colonne vertébrale et permet la prise d’une mesure plus uniforme et reproductible.
- L’équerre amovible a été placée fermement sur le dessus de la tête en exerçant une pression suffisante pour comprimer la chevelure.
- La taille en position debout a été enregistrée au 0,01 cm près pendant que le répondant retenait sa respiration.
1.2 Taille en position assise
La taille en position assise est une évaluation de la taille verticale maximale lorsque le répondant est assis. Elle a été mesurée pour tous les répondants de 6 ans et plus capables de se tenir assis sans aide. La taille en position assise a été mesurée au moyen d’un stadiomètre fixe doté d’une planche dorsale verticale et d’une équerre amovible. Combinée à la taille en position debout, cette mesure permet d’évaluer les proportions corporelles (p. ex. la longueur des jambes relativement au tronc). La combinaison de la stature et de la taille en position assise (au moyen d’une équation prédictive) fournit un indice de maturité corporelle des populations jeunes. La taille en position assise a été mesurée selon le protocole de l’International Society for the Advancement of Kinanthropometry (ISAK)2.
1.2.1 Équipement
- Stadiomètre numérique ProScale M150.
- Banc ou bloc normalisé.
1.2.2 Admissibilité
- Les répondants de 6 à 79 ans.
1.2.3 Critères d’exclusion
- Les répondants qui ne pouvaient pas se tenir assis sans aide.
- Les répondants qui souffraient d’une maladie aiguë les empêchant de subir la mesure (p. ex. jambe plâtrée).
1.2.4 Mesure de la taille en position assise
-
Le SMS a demandé au répondant de déplacer ou d’enlever les décorations, bijoux, chignon ou tresses du dessus de sa tête.
-
Le répondant devait s’asseoir sur la boîte, les mains reposant sur ses cuisses, et son dos, ses épaules et sa tête touchant la planche dorsale verticale du stadiomètre. Selon la forme corporelle générale du répondant, il est arrivé que tous les points ne touchaient pas la planche verticale. Dans ce cas, on s’est assuré que le tronc du répondant était à la verticale à partir de la taille et que ses bras et ses épaules étaient détendus.
-
Le SMS a demandé au répondant de regarder droit devant lui. La tête du répondant était alignée en fonction du plan de Frankfort. La tête se trouve dans le plan de Frankfort lorsque la ligne horizontale qui va du conduit auditif jusqu’au bord inférieur de l’orbite de l’œil est parallèle au sol et perpendiculaire à la planche dorsale verticale. Au besoin, le SMS a déplacé doucement la tête du répondant vers le haut ou vers le bas jusqu’à ce que l’alignement approprié soit atteint, pendant que le regard du répondant se portait droit devant.
Nota : Si un répondant ne pouvait pas garder sa tête en contact avec le stadiomètre lorsqu’il était dans la position du plan de Frankfort, c’est la position du plan de Frankfort qui a eu préséance sur le contact du derrière de la tête avec le stadiomètre.
-
Le répondant devait se tenir le plus droit possible, respirer profondément et retenir son souffle pendant la prise de la mesure. Le SMS s’est assuré que le répondant ne contractait pas les muscles fessiers et ne poussait pas avec les jambes.
-
L’équerre amovible a été placée fermement sur le dessus de la tête en exerçant une pression suffisante pour comprimer la chevelure.
-
La taille en position assise a été enregistrée au 0,01 cm près pendant que le répondant retenait sa respiration.
-
La hauteur de la boîte a été soustraite pour obtenir la taille en position assise du répondant au 0,01 cm près.
1.3 Poids
Le poids a été mesuré en kilogrammes (kg) au moyen d’une balance numérique et a servi à calculer l’indice de masse corporelle. La procédure était fondée sur le Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller )1.
1.3.1 Équipement
- Balance Mettler Toledo VLC avec terminal Panther Plus.
1.3.2 Admissibilité
- Tous les répondants de 6 à 79 ans.
1.3.3 Critères d’exclusion
- Les répondants qui souffraient d’une maladie aiguë les empêchant de subir la mesure (voir la section sur les facteurs spéciaux à considérer ci‑dessous).
- Les répondants qui portaient un plâtre.
1.3.4 Mesure du poids
-
Le SMS a demandé au répondant d’enlever ses chaussures, ainsi que tout accessoire, et de vider ses poches.
-
Le répondant devait monter sur le centre de la balance en faisant face au SMS, garder les mains de chaque côté de son corps et regarder droit devant lui.
-
Le poids a été enregistré au 0,01 kg près.
1.3.5 Considérations spéciales
Le poids corporel pouvait être mesuré au moyen de la technique normalisée si la personne pouvait se soutenir sur la balance sans aide. La mesure du poids corporel ne devait pas comprendre le poids d’appareils fonctionnels (p. ex. membres artificiels, attelles, jambières, béquilles, etc.), même si ces appareils étaient souvent nécessaires pour que le poids de la personne soit mesuré. Dans ces cas, l’appareil a d’abord été placé sur la balance, qui a pu être tarée. La personne a ensuite pu se tenir debout sur la balance au moyen de l’appareil fonctionnel et son poids a pu être affiché.
Les personnes qui ne pouvaient pas se tenir en équilibre seules sur la balance ont pu être pesées assises sur une chaise. La chaise a été placée sur la balance, celle‑ci a été tarée, et le répondant s’est assis sur la chaise. Le poids de la personne a alors pu être affiché.
1.4 Circonférence de la taille
Le profil de répartition du tissu adipeux est un indicateur important des risques que l’obésité pose pour la santé. L’accumulation centrale de tissus adipeux (tissus adipeux sur le tronc), particulièrement le tissu adipeux abdominal, est associée à une augmentation du risque d’hypertension, de diabète de type 2, d’hyperlipidémie, de maladie coronarienne et de décès prématuré. La circonférence de la taille donne un indice de l’accumulation abdominale de tissu adipeux. La procédure est fondée sur la troisième édition du Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller )1.
1.4.1 Équipement
- Ruban Gulick (150 cm ou 200 cm).
1.4.2 Admissibilité
- Tous les répondants de 6 à 79 ans.
1.4.3 Critères d’exclusion
- Femmes enceintes.
- Répondant en fauteuil roulant (lorsque les points de repère ne pouvaient pas être marqués correctement).
- Répondant qui ne peut se tenir debout sans aide.
- Poche pour colostomie.
1.4.4 Mesure de la circonférence de la taille
-
Le SMS a demandé au répondant de se tenir debout, de façon détendue, les pieds distancés à la largeur des épaules, les bras légèrement devant (à un angle de 45°) et les paumes des mains tournées vers le corps. La mesure devait être prise directement sur la peau.
-
Des points de repères ont été marqués de chaque côté du répondant avec un crayon délébile. Le premier point se situait au bas de la cage thoracique, et le deuxième point, au‑dessus de la crête iliaque. Les deux marques devaient se situer au niveau de la ligne axillaire. Au besoin, le SMS a demandé l’aide du répondant pour localiser ou confirmer les points de repère. La distance médiane entre les deux points de repère a été mesurée et marquée au moyen du ruban à mesurer.
-
En se tenant à la droite du répondant, le SMS a placé le ruban à mesurer autour de la taille du répondant à l’endroit marqué. Un miroir a servi à vérifier si le ruban était à la bonne hauteur. S’il y avait une différence visible entre les deux points de repère, le point de repère droit a été utilisé. Le SMS a appliqué une tension suffisante sur le ruban à mesurer, sans trop serrer.
-
Une fois le ruban à mesurer au bon endroit, le SMS a demandé au répondant de se détendre, les bras le long du corps.
-
Le répondant devait respirer normalement.
-
Le SMS s’est assuré que ses yeux étaient à la hauteur du ruban à mesurer. La mesure a été prise à la fin d’une expiration normale. On a utilisé la technique croisée et on a lu la mesure sur la base inférieure du ruban à mesurer.
-
Le SMS a enregistré la mesure au 0,1 cm près.
1.5 Circonférence des hanches
La circonférence des hanches est la circonférence maximale mesurée aux hanches ou aux fesses (la plus grande de ces circonférences) au-dessus du pli fessier. Elle sert à calculer le rapport de la taille aux hanches (la circonférence de la taille divisée par la circonférence des hanches). Le rapport de la taille aux hanches constitue une méthode simple pour déterminer la distribution de la masse adipeuse. Bien que les normes de risque varient selon l’âge et le sexe, les risques pour la santé augmentent plus le rapport de la taille aux hanches est élevé. Le protocole de mesure de la circonférence des hanches est fondé sur la troisième édition du Physitest canadien normalisé3.
1.5.1 Équipement :
- Ruban à mesurer Gulick (150 cm ou 200 cm).
1.5.2 Admissibilité :
- Tous les répondants de 6 à 79 ans.
1.5.3 Critères d’exclusion :
- Femmes enceintes.
- Répondant en fauteuil roulant.
- Répondant qui ne peut pas se tenir debout sans aide.
1.5.4 Mesure de la circonférence des hanches
-
Le répondant devait porter des vêtements légers. Il devait se tenir debout, droit et de façon détendue, les pieds ensemble, les bras légèrement devant (à un angle de 45°) et les paumes des mains tournées vers le corps. Si le répondant ne portait pas de vêtement léger (p. ex. un short ou un pantalon d’entraînement léger), on lui a fourni une blouse chirurgicale, afin de s’assurer d’un minimum d’interférence lors de la prise de la circonférence des hanches.
-
Le répondant devait se ternir debout en répartissant également son poids sur ses deux jambes. Il devait respirer normalement.
-
La mesure a été prise par dessus les vêtements. En se tenant à la droite du répondant, le SMS a placé le ruban à mesurer autour des hanches, à la hauteur de la symphyse pubienne et de la circonférence maximale des hanches ou des fesses. Un miroir a servi à vérifier si le ruban était à la hauteur des points de repère et à s’assurer qu’il demeure dans le plan horizontal. Le ruban devait être bien ajusté sans être serré.
-
Une fois le ruban à mesurer au bon endroit, le SMS a demandé au répondant de se détendre, les bras le long du corps. La mesure a été prise du côté droit du répondant. On a utilisé la technique croisée et on a lu la mesure sur la base inférieure du ruban à mesurer.
-
Le SMS a en registré la mesure au 0,1 cm près.
1.6 Mesure des plis cutanés
La mesure des plis cutanés sert à estimer l’adiposité générale et la répartition du tissu adipeux sous-cutané. La technique repose sur le principe selon lequel la quantité de tissu adipeux sous-cutané (tissu adipeux situé directement sous la peau) est proportionnelle à la quantité totale de tissu adipeux dans l’organisme. L’excès et l’insuffisance de tissu adipeux sont tous deux associés à une augmentation des risques pour la santé. La mesure des plis cutanés est fondée sur le Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller )1.
1.6.1 Équipement
- Adipomètre Harpenden.
- Marqueur délébile à pointe fine.
- Ruban à mesurer Gulick (150 cm).
1.6.2 Admissibilité
- Tous les répondants de 6 à 79 ans.
1.6.3 Critères d’exclusion
- Femmes enceintes.
- Répondants dont l’IMC est supérieur ou égal à 30 kg/m2.
- Répondants souffrant d’une maladie aiguë qui les empêche de subir la mesure (p. ex. varices, maladie de la peau). Cela a donné lieu à une exclusion pour ce pli cutané seulement.
- Répondants souffrant d’une maladie chronique qui les empêche de subir la mesure (p. ex. répondant dans un fauteuil roulant, ce qui empêche de marquer les points de repère correctement, ou répondant à qui il manque un membre du côté droit). Cela a donné lieu à une exclusion pour ce pli cutané seulement.
1.6.4 Mesure des plis cutanés
-
Avant de mesurer les plis cutanés, le SMS devait marquer chaque emplacement avec soin. Le SMS a marqué l’emplacement du site, ainsi qu’un point de repère à 1 cm du pli cutané, afin de déterminer où placer la partie supérieure des pinces de l’adipomètre. Les marques indiquaient où se trouvait le centre du pli. Toutes les marques et les mesures ont été faites du côté droit du corps.
-
Le SMS a procédé au premier ensemble de mesures des plis cutanés à tous les emplacements, puis a répété la procédure pour obtenir une deuxième mesure à tous les emplacements.
Nota : Si la différence entre la première et la deuxième mesure d’un pli cutané était supérieure à 0,4 mm, l’ordinateur a indiqué au SMS de prendre une troisième mesure à cet emplacement. Parmi les trois valeurs, l’ordinateur a choisi ensuite les deux mesures dont la valeur était la plus rapprochée et a fait la moyenne de ces deux mesures. L’ordinateur a déterminé la moyenne des trois mesures si celles‑ci étaient à distance égale (p. ex. 18,6 mm, 19,4 mm, 19,0 mm).
-
Pendant la mesure des plis cutanés, il était important que le répondant détende sa musculature sous‑jacente le plus possible.
-
Le SMS a écarté complètement le pouce et l’index pour pouvoir empoigner fermement le pli cutané et le tissu adipeux sous‑cutané entre son pouce et son index. La dimension du pli dépendait de l’épaisseur du tissu adipeux sous‑cutané. Le SMS devait tenir assez de tissu adipeux et cutané pour former un pli distinct séparé du muscle sous‑jacent. Le SMS s’est assuré que le point de repère se situait au centre du pli cutané. Les côtés du pli devaient être parallèles, en général. Le pli cutané devait être tenu entre le pouce et l’index à l’endroit où la mesure devait être prise.
-
Le SMS a placé les branches de l’adipomètre à angle droit de la surface corporelle, la partie supérieure des branches de l’adipomètre à 1 cm sous le point où le pli cutané était soulevé. En maintenant une pression sur le pli cutané avec ses doigts, le SMS a relâché entièrement la gâchette de l’adipomètre.
-
Le SMS a mesuré l’épaisseur du pli cutané au 0,2 mm près (à la décimale paire près) tout en continuant de tenir le pli entre ses doigts. Le SMS a lu la mesure réelle de l’adipomètre une fois que l’indicateur s’est stabilisé (environ deux secondes après que toute la pression de l’adipomètre ait été appliquée à la peau).
-
Le SMS a lu la mesure du pli cutané avant de le lâcher. Il a ensuite enlevé l’adipomètre, puis relâché le pli cutané et le gras sous‑cutané et enregistré la mesure.
1.6.5 Pli cutané du triceps
-
Le SMS a demandé au répondant de se tenir debout, les bras pendants de chaque côté du corps et les paumes des mains tournées vers le corps.
-
Pour déterminer le point de repère du pli cutané, le SMS a amené l’avant‑bras du répondant à un angle de 90º, la paume de la main vers le haut.
-
Le SMS a palpé la pointe de l’acromion et la pointe de l’olécrane et déterminé le point médian entre ces deux emplacements au moyen d’un ruban à mesurer. Il a marqué le point médian au moyen d’un crayon marqueur délébile. Le point médian a servi de référence pour faire la marque sur la ligne médiane de l’arrière du bras. Le SMS a marqué également l’emplacement de la partie supérieure des pinces, à 1 cm en dessous de l’emplacement de la prise du pli.
-
Le SMS a demandé au répondant d’étendre le bras vers le bas, la paume de la main tournée vers la cuisse.
-
Le pli cutané a été soulevé au point médian de façon que le pli soit à la verticale le long de la ligne médiane de l’arrière du bras.
-
La partie supérieure des pinces de l’adipomètre a été placée à un 1 cm sous le pli cutané.
-
Une fois l’indicateur stabilisé, le SMS a lu la mesure de l’épaisseur du pli cutané au 0,2 mm près (à la décimale paire près) tout en continuant de tenir le pli cutané entre ses doigts.
1.6.6 Pli cutané du biceps
-
Le SMS a demandé au répondant d’étendre le bras sur le côté du corps, la paume de la main tournée vers l’avant (supination).
-
Le SMS a fait une marque sur le bras au‑dessus du biceps au même niveau que le point médian marqué pour le triceps.
-
Il a marqué également l’emplacement de la partie supérieure des pinces, à 1 cm en dessous de l’emplacement de la prise du pli.
-
Il a soulevé le pli cutané au milieu du bras, de façon que le pli soit à la verticale de la ligne médiane du devant du bras. Il a placé la partie supérieure des pinces de l’adipomètre à 1 cm sous le pli cutané.
-
Une fois l’indicateur stabilisé, le SMS a lu la mesure de l’épaisseur du pli cutané au 0,2 mm près (décimale paire près) tout en continuant de tenir le pli cutané entre ses doigts.
1.6.7 Pli cutané sous-scapulaire
-
Le SMS a demandé au répondant de se tenir debout en lui tournant le dos, les épaules détendues et les bras de chaque côté.
-
Pour déterminer le point repère, le SMS a palpé l’angle inférieur de l’omoplate. Il a fait une marque 1 cm sous l’angle inférieur de l’omoplate. Le SMS a marqué également l’emplacement de la partie supérieure des pinces, à 1 cm en direction du pli, c’est‑à‑dire à un angle de 45° de la colonne vertébrale.
-
Le pli cutané était orienté vers le bas et l’extérieur à un angle de 45° de la colonne vertébrale. Le pli cutané devait former une diagonale qui s’étendait vers le coude droit.
-
Le SMS a placé la partie supérieure des pinces de l’adipomètre sur le point de repère, à 1 cm sous le pli cutané.
-
Une fois l’indicateur stabilisé, le SMS a lu la mesure de l’épaisseur du pli cutané au 0,2 mm près (décimale paire près) tout en continuant de tenir le pli cutané entre ses doigts.
1.6.8 Pli cutané à la crête iliaque
-
Le SMS a demandé au répondant de se tenir debout en position normale, de placer son bras droit à l’horizontale sur le côté et de placer la main droite sur l’épaule droite. Si le répondant ne pouvait pas placer la main sur l’épaule, il devait tenir le bras étendu à l’horizontale.
-
Pour déterminer le point de repère, le SMS a palpé la crête iliaque et a fait une petite marque 3 cm au‑dessus, à l’axe de la ligne médiane du corps. Il a marqué également l’emplacement de la partie supérieure des pinces, à 1 cm devant le point de soulèvement du pli cutané, dans la direction du pli.
-
Le SMS a soulevé le pli cutané à la marque de 3 cm de façon que le pli soit orienté vers l’avant et légèrement vers le bas.
-
Il a placé la partie supérieure des pinces de l’adipomètre 1 cm devant le point de soulèvement du pli cutané, dans la direction du pli.
-
Une fois l’indicateur stabilisé, le SMS a lu la mesure de l’épaisseur du pli cutané au 0,2 mm près (décimale paire près) tout en continuant de tenir le pli cutané entre ses doigts.
1.6.9 Pli cutané du mollet
-
Le SMS a demandé au répondant de placer son pied droit (détendu) à plat sur une marche, le genou à un angle de 90°.
-
Pour déterminer le point de repère, le SMS a utilisé un ruban à mesurer pour trouver la partie la plus charnue du mollet. Le SMS a fait une marque à la face interne de la partie la plus charnue du mollet. Il a marqué également l’emplacement de la partie supérieure des pinces, à 1 cm en dessous de l’emplacement de la prise du pli.
-
Le SMS a soulevé le pli cutané à la face interne du mollet, au niveau de la partie la plus charnue et a formé le pli verticalement le long de la ligne médiane.
-
Le SMS a placé la partie supérieure des pinces de l’adipomètre à 1 cm du point de soulèvement du pli cutané.
-
Une fois l’indicateur stabilisé, le SMS a lu la mesure de l’épaisseur du pli cutané au 0,2 mm près (décimale paire près) tout en continuant de tenir le pli cutané entre ses doigts.
1.6.10 Considérations spéciales
Même si la mesure du pli cutané pouvait en théorie toujours être pratiquée (sauf lorsqu’une partie du corps était manquante), elle n’était pas nécessairement appropriée. On a pris la mesure du pli cutané uniquement pour les parties du corps dont la composition n’était pas affectée par une incapacité, certaines incapacités pouvant augmenter la difficulté à obtenir des mesures du pli cutané fiables. Par exemple, une paralysie rend difficile la mesure exacte du pli cutané en raison de l’absence de tonus des muscles sous-jacents. Il est possible d’isoler le gras des couches musculaires en massant le pli cutané entre le pouce et l’index.
2. Composante de la tension artérielle
La fréquence cardiaque et la tension artérielle (TA) du répondant au repos ont été mesurées, selon un nouveau protocole créé par l’ECMS et inspiré par le rapport intitulé « Hypertension Surveillance in Canada: Minimum Standards for Assessing Blood Pressure In Surveys »8. Ce rapport a été publié par un comité d’experts constitué de membres de la Société canadienne d’hypertension artérielle, de la Coalition canadienne pour la prévention et le contrôle de l’hypertension artérielle et de la Fondation des maladies du cœur du Canada.
À des fins de normalisation, toutes les mesures devaient être faites sur le bras droit, à moins que des conditions spéciales ne l’empêchent (p. ex. mastectomie du côté droit), en utilisant le brassard de tension artérielle automatisé (BpTRU™). Le BpTRU™ est conçu pour mesurer la tension artérielle et la fréquence cardiaque à l’aide d’un brassard enroulé autour du bras. L’appareil gonfle et dégonfle automatiquement le brassard et s’appuie sur la technique oscillométrique pour calculer les tensions systolique et diastolique. Si le brassard automatisé ne fonctionnait pas correctement, le SMS a pris la mesure manuellement par la méthode d’auscultation.
2.1 Équipement
Mode électronique
- Moniteur de TA automatisé : BpTRU™ BP-300 (avec saisie automatique).
- Brassards de TA automatisés de diverses tailles (de taille « enfant » à « adulte très grand »).
- Repose-pieds pour les répondants plus petits.
Mode manuel (méthode d’auscultation)
- Stéthoscope : Littman Classic II SE (adultes), Littman™ Classic II pédiatrique (enfants).
- Manomètre à mercure.
- Brassards de TA à gonflage manuel de diverses tailles (de taille « enfant » à « adulte très grand »).
- Moniteur de fréquence cardiaque (Polar).
- Repose-pieds pour les répondants plus petits.
- Chronomètre.
2.2 Admissibilité
- Tous les répondants de 6 à 79 ans.
2.3 Critères d’exclusion
Exclusion du test
- Présence des caractéristiques suivantes aux deux bras : éruption cutanée, pansement de gaze, plâtre, œdème, paralysie, tubes, plaies ouvertes, bras décharnés, intraveineuse.
- Brassard de TA trop petit ou trop grand pour le bras.
Exclusion du bras droit
- Prélèvement de sang au niveau du bras droit au cours de la dernière semaine.
- Présence des caractéristiques suivantes sur le bras droit: éruption cutanée, pansement de gaze, plâtre, œdème, paralysie, tubes, plaies ouvertes, bras décharnés, intraveineuse.
- Mastectomie du côté droit.
- Bras droit amputé.
- Bras droit plâtré.
2.4 Mesure de la tension artérielle
2.4.1 Mode électronique
-
Le répondant a été installé dans un endroit calme et confortable. Il s’est assis avec le bras soutenu et reposant confortablement au niveau du cœur (l’emplacement du cœur est situé à l’intersection du quatrième espace intercostal et du bord inférieur gauche du sternum).
-
On a choisi la taille de brassard appropriée selon la circonférence du bras.
-
Le brassard a été enroulé à plat et de façon bien serrée autour du bras droit du répondant (le bras devait être nu) en centrant la vessie (poche gonflable) sur l’artère brachiale. Le bord inférieur du brassard devait se situer à 2 cm ou 3 cm au‑dessus du pli du coude (fosse antécubitale). Le spécialiste des mesures de la santé (SMS) devait s’assurer que les vêtements du répondant n’empêchaient pas le sang de circuler dans le bras (c’est‑à‑dire qu’il ne fallait pas rouler la manche du répondant, mais plutôt lui fournir une chemise à manches courtes).
Nota : S’il n’était pas possible d’utiliser le bras droit du répondant (se reporter aux critères d’exclusion du bras droit), on a utilisé le bras gauche.
-
Le répondant devait rester assis calmement pendant au moins cinq minutes avant de prendre la mesure (avec le brassard déjà sur son bras). Il devait relaxer et ne pas parler ni bouger pendant cette période de repos de cinq minutes.
- Le SMS s’est assuré que le répondant était correctement assis, c’est‑à‑dire :
a. Pieds à plat sur le sol (pour les répondants de petite taille, un repose-pieds a été utilisé).
b. Jambes/chevilles non croisées.
c. Dos appuyé au dossier de la chaise.
d. Bras droit reposant étendu sur la table à la hauteur du cœur avec la paume de la main tournée vers le bas.
- Avant de commencer la mesure, on a demandé au répondant de ne pas bouger ni parler pendant le test.
- La tension artérielle a été déterminée automatiquement par le BpTRU™ BP-300, soit la moyenne de cinq mesures répétées obtenues à des intervalles d’une minute. (Au total, on a pris six mesures de la tension artérielle, mais la première a été exclue du calcul de la moyenne.)
- Il a fallu au minimum trois lectures pour procéder à la mesure. Si plus de deux erreurs se sont produites (effet du mouvement), le SMS a repris la série de six mesures.
- Moins de trois mesures valides ont été obtenues pour la TA et la FC. Une mesure était considérée comme invalide si :
a. Moins de trois mesures valides ont été obtenues pour la TA et la FC. Une mesure était considérée comme invalide si :
- il y avait une erreur du BpTRUTM;
- pour l’un ou l’autre des essais, la TA systolique – TA diastolique était de < 20 ou > 200.
b. La variabilité entre les mesures était trop grande :
- TA systolique la plus élevée – TA systolique la plus faible > 30;
- TA diastolique la plus élevée – TA diastolique la plus faible > 20;
- TA la plus élevée – TA la plus faible > 30.
- Une fois le deuxième ensemble de mesures de la tension artérielle pris, le SMS a décidé si un troisième ensemble de mesures était nécessaire ou non à partir des données du tableau 1.
c. La tension artérielle moyenne (>144/94 mmHg) et/ou la fréquence cardiaque (≥100 bpm) du répondant était élevée.
| Résultat de la première série de mesures | Résultat de la deuxième série de mesures | Suivi |
|---|---|---|
| Obtention de moins de trois mesures valides ou trop grande variabilité entre les mesures | Obtention de moins de trois mesures valides ou variabilité trop grande. | Refaire les mesures une troisième et dernière fois par auscultation. |
| La TA (>144/94 mmHg) et/ou la fréquence cardiaque (≥100 bpm) du répondant sont élevées. | Refaire les mesures une troisième et dernière fois à l’aide du BpTRU™ pour confirmer. | |
| Obtention d’au moins trois mesures valides, variabilité dans la fourchette acceptable et TA considérée normale. | Accepter les mesures et aller à la fin de la composante. | |
| TA ou FC élevée TAS >144 mmHg et/ou TAD > 94 mmHg) et/ou FR ≥100 bpm |
TA (>144/94 mmHg) et/ou FR (≥100 bpm) sont élevées à nouveau. | Accepter les mesures et aller à la fin de la composante. Lire le message de TA et/ou de FC élevée au répondant. |
| Obtention de moins de trois mesures valides ou variabilité trop grande. | Refaire les mesures une troisième et dernière fois avec le BpTRU™ pour confirmer la première série de résultats. | |
| Obtention d’au moins trois mesures valides, variabilité dans la fourchette acceptable et TA moyenne considérée normale. | Accepter les mesures et aller à la fin de la composante. |
2.4.2 Mode manuel (méthode d’auscultation)
- Le répondant a été installé dans un endroit calme et confortable. Il s’est assis avec le bras soutenu et reposant confortablement au niveau du cœur (l’emplacement du cœur est situé à l’intersection du quatrième espace intercostal et du bord inférieur gauche du sternum).
- Le SMS a aidé le répondant à mettre le moniteur de fréquence cardiaque. La sangle a été ajustée de manière à obtenir un bon résultat.
- On a choisi la taille de brassard appropriée selon la circonférence du bras et on a marqué l’emplacement de l’artère brachiale où devait être centré le brassard.
- Le brassard a été enroulé à plat et de façon bien serrée autour du bras droit du répondant (le bras devait être nu) en centrant la vessie (poche gonflable) sur l’artère brachiale. Le bord inférieur du brassard devait se situer à 2 cm ou 3 cm au‑dessus du pli du coude (fosse antécubitale). Le SMS devait s’assurer que les vêtements du répondant n’empêchaient pas le sang de circuler dans le bras (c’est‑à‑dire qu’il ne fallait pas rouler la manche du répondant).
Nota : S’il n’était pas possible d’utiliser le bras droit du répondant (se reporter aux critères d’exclusion du bras droit), on a utilisé le bras gauche.
- Le répondant devait rester assis calmement pendant au moins cinq minutes avant de prendre la mesure (avec le brassard déjà sur son bras). Il devait relaxer et ne pas parler ni bouger pendant cette période de repos de cinq minutes.
- Le SMS s’est assuré que le répondant était correctement assis, c’est‑à‑dire :
a. Pieds à plat sur le sol (pour les répondants de petite taille, un repose-pieds a été utilisé).
b. Jambes/chevilles non croisées.
c. Dos appuyé au dossier de la chaise.
d. Bras droit reposant étendu sur la table à la hauteur du cœur avec la paume de la main tournée vers le bas.
- Avant de commencer la mesure, on a demandé au répondant de ne pas bouger ni parler pendant le test.
- La pression de gonflage maximale (PGM) a été déterminée. La PGM ou méthode de palpitation donne une approximation de la tension systolique, afin de déterminer la pression la plus élevée à laquelle le brassard doit être gonflé au moment de la mesure réelle. La PGM a été déterminée de la façon suivante.
a. On a positionné le bras droit du répondant avec la paume de la main tournée vers le haut. Le SMS a repéré le pouls radial sur le bras droit.
b. Le SMS a gonflé le brassard rapidement jusqu’à une tension de 70 à 80 mmHg. Puis il l’a gonflé par tranche de 10 mmHg jusqu’à ce que le pouls radial ne soit plus palpable (systolique palpé). Il a continué de gonfler le brassard par tranche de 10 mmHg jusqu’à une mesure finale qui était 30 mmHg au‑dessus de la pression où le dernier pouls a été palpé. Ce chiffre a été enregistré comme correspondant à la PGM.
c. Le brassard a été dégonflé rapidement et le retour du pouls a été confirmé.
d. Si le SMS n’était pas été en mesure d’obtenir la PGM, il a attendu une minute et a répété le processus.
- Les procédures qui suivent ont été utilisées pour la lecture de la tension artérielle en position assise :
- Le SMS a placé les embouts auriculaires du stéthoscope dans les conduits auditifs externes en inclinant les tubes vers l’avant afin qu’ils soient bien ajustés.
- Le SMS a confirmé que la tête du stéthoscope était à une des deux positions basses fréquences. Pour écouter les sons de basse fréquence, on peut utiliser soit le petit pavillon, soit la membrane à double fréquence en touchant à peine la peau. Si la cloche du stéthoscope était utilisée, elle a été placée sur l’artère brachiale et maintenue fermement en place. Si la membrane à double fréquence était utilisée, elle a été placée sur l’artère brachiale et pressée légèrement contre la peau. Le SMS s’est assuré que la tête était en contact avec la peau sur toute sa circonférence dans les deux positions. Il a évité dans la mesure du possible que le brassard, la tubulure, le petit pavillon ou la membrane soient en contact avec les uns avec les autres.
- Le chronomètre a été lancé (pour mesurer les intervalles entre les mesures), et le brassard a été gonflé rapidement jusqu’à la PGM.
- Lorsque la PGM a été atteinte, la valve manuelle a été ouverte et on a laissé le brassard se dégonfler doucement à une vitesse constante (environ 2 mmHg ou une graduation par seconde), tandis que le SMS écoutait les bruits de Korotkoff.
- En gardant le manomètre au niveau des yeux, le SMS a surveillé le sommet de la colonne de mercure (ménisque), à mesure que la pression a baissé dans la vessie (poche gonflable), et a noté le niveau du ménisque lorsque les premiers bruts répétitifs ont été entendus (phase I) et quand ils sont disparus (phase V).
- Le dégonflage du brassard s’est poursuivi à 2 mmHg par seconde, jusqu’à une baisse supplémentaire d’au moins 10 mmHg après celle où les derniers bruits ont été entendus.
- Le SMS a dégonflé rapidement le brassard et a débranché la tubulure du manomètre entre les mesures pour s’assurer que le brassard était complètement dégonflé et pour laisser le répondant se reposer calmement pendant au moins 30 secondes.
- Le SMS a enregistré la lecture de la phase I (le niveau du ménisque sur le manomètre à la première apparition des bruits réplétifs) comme lecture de la tension systolique, et la lecture de la phase V (le niveau du ménisque sur le manomètre à la dernière apparition des bruits répétitifs) comme lecture de la tension diastolique.
Nota : Si la phase I ou la phase V a eu lieu entre les graduations millimétriques de la colonne de verre, le SMS l’a arrondi vers le haut, au chiffre le plus près.
- Le SMS a répété les étapes « a » à « h » cinq autres fois, afin de prendre six mesures en tout, à des intervalles d’une minute.
- Une fois la sixième mesure entrée, l’application a calculé automatiquement la moyenne d’après des directives préétablies.
- Les données des six mesures ont été affichées à l’écran de l’ordinateur et le SMS les a passées en revue et a choisi de les accepter ou de procéder à de nouvelles mesures, selon les mêmes critères que ceux énoncés précédemment dans la procédure pour la mesure automatisée de la TA.
- Le SMS a placé les embouts auriculaires du stéthoscope dans les conduits auditifs externes en inclinant les tubes vers l’avant afin qu’ils soient bien ajustés.
3. Composante de la spirométrie
La composante de la spirométrie comprend deux blocs, le bloc des restrictions relatives à la spirométrie (SPR) et le bloc de la mesure de la spirométrie (SPM). Les données relatives au bloc des restrictions relatives à la spirométrie sont incluses dans le questionnaire de la partie clinique4.
Les principaux volumes mesurés sont les suivants :
- la capacité vitale forcée (CVF), qui correspond au volume maximum d’air expulsé au cours d’une expiration effectuée le plus rapidement et le plus profondément possible en partant de la position d’une inspiration complète, c’est-à-dire la capacité vitale obtenue après un effort d’expiration forcée maximal exprimé en litres selon la norme BTPS5.
- le volume expiratoire maximal par seconde (VEMS), qui correspond au volume maximal d’air expulsé pendant la première seconde d’une expiration forcée après une inspiration complète. Ce volume est exprimé en litres selon la norme BTPS5.
Nota : Pour les répondants de 6 et 7 ans, les équations prédites ont été tirées de « Corey 1976 ». Pour les répondants de 8 ans et plus, les équations prédites ont été tirées d’« Hankinson (NHANES III) ».
Si l’âge, la taille et le poids du répondant étaient en dehors de l’échelle établie pour l’équation des valeurs prédites ayant été sélectionnée, les valeurs prédites ont été extrapolées.
3.1 Équipement
- Spiromètre Koko.
- Embouts buccaux jetables – avec filtre.
- Adaptateurs pédiatriques – au besoin.
- Pince-nez jetable.
- Seringue d’étalonnage de 3 litres.
- Baromètre/thermomètre
3.2 Admissibilité
- Tous les répondants de 6 à 79 ans.
3.3 Critères d’exclusion
- Répondant avec une stomie (exposition à la surface externe du corps d’un organe interne dû à une ouverture chirurgicale, c.‑à‑d. colostomie, trachéostomie).
- Femmes enceintes (> 27 semaines).
- Crise cardiaque au cours des trois derniers mois.
- Chirurgie thoracique ou abdominale lourde au cours des trois derniers mois.
- Répondant prenant des médicaments contre la tuberculose.
- Chirurgie récente des yeux (p. ex. cataracte, ≤ 6 semaines).
- Affection respiratoire aiguë, par exemple rhume, bronchite, grippe.
- Barrière linguistique importante.
- Difficulté respiratoire au repos.
- Toux persistante.
3.4 Administration du test de spirométrie
- Le spécialiste des mesures de la santé (SMS) a enregistré l’« ajustement racial » approprié pour le répondant (voir le tableau 2). Pour une taille donnée en position debout, les personnes de certaines ethnies ont tendance à avoir les jambes plus longues et le tronc plus court que les Caucasiens et, par conséquent, de plus petits poumons. On ne devrait donc pas leur attribuer la même capacité pulmonaire prévue qu’aux Caucasiens.
Si, pendant l’interview du ménage, le répondant a déclaré plus d’une origine culturelle ou raciale (p. ex. noir et arabe à la question SDC_Q24), le SMS a choisi un ajustement racial selon son évaluation visuelle. La variable de la race du ménage représente l’origine culturelle et raciale autodéclarée par le répondant, tandis que la variable d’ajustement racial (SPM_022) permet d’ajuster les données de spirométrie en fonction des différences morphologiques entre les races. Ainsi, ces deux variables peuvent varier chez certains répondants. La variable SPM_022 devrait uniquement être utilisée conjointement avec des analyses de spirométrie. - Le SMS a fourni des instructions rigoureuses et fait une démonstration (sans utiliser l’embout buccal) avant de demander au répondant de faire le test. Le test de spirométrie dépend dans une large mesure de l’effort du répondant. Par conséquent, il est important que le SMS ait adopté une technique d’encadrement appropriée pour obtenir les meilleurs résultats possibles de chaque répondant.
- Le répondant devait s’asseoir bien droit, les deux pieds à plat sur le sol pendant toute la durée du test. On lui a demandé de ne pas pencher le buste vers l’avant pendant l’expiration. Les répondants plus âgés qui effectuaient le test n’ont pas eu à enlever leurs dentiers si ceux‑ci étaient bien ajustés, étant donné qu’ils préservent la géométrie oropharyngé et que les résultats du test de spirométrie sont généralement meilleurs de cette façon5.
- Le SMS a aidé le répondant pour s’assurer que le pince-nez était solidement en place. Le répondant devait porter un pince-nez pendant le test, afin d’éviter que l’air ne s’échappe de son nez.
- Le répondant a placé l’embout dans sa bouche et s’est assuré de le sceller correctement avec ses lèvres pour empêcher les fuites d’air et que ses dents soient décontractées autour de l’embout buccal.
- Le répondant devait respirer normalement à travers l’embout buccal.
- Après quelques respirations normales, le répondant devait inspirer profondément et rapidement en remplissant ses poumons d’air.
- À la fin de l’inspiration maximale, le répondant devait expulser immédiatement tout l’air de ses poumons le plus fort et le plus vide possible. Il était important que le répondant ne retienne pas son souffle avant de commencer à expirer.
- Le SMS a encouragé le répondant pendant l’expiration. Quand le répondant a atteint un plateau d’une seconde sur la courbe volume-temps, et a exhalé pendant au moins six secondes (ou trois secondes pour les enfants de 6 à 10 ans), le SMS lui a demandé d’inspirer profondément (deuxième inspiration maximale).
- Après la deuxième inspiration maximale, le répondant devait enlever l’embout buccal et le pince‑nez.
- Après chaque essai, le SMS a dû décider de maintenir les résultats ou non. Il l’a fait après avoir évalué la qualité de l’essai (à partir des explications de la section « Évaluation de la qualité d’un essai » ci‑après).
- On a permis au répondant de se reposer un peu (environ 30 à 45 secondes) entre les essais, afin qu’il puisse reprendre son souffle. Le SMS a observé constamment les signes de fatigue chez le répondant et n’a pas autorisé un nouvel essai tant que le répondant n’avait pas récupéré entièrement du premier.
- Le SMS a exécuté au minimum trois essais acceptables sur un maximum de huit essais complets. Si après huit essais il n’y avait pas d’essai reproductible, on a sélectionné le meilleur essai et on a enregistré les essais.
- Le meilleur essai correspond à la somme de la CVF et du VEMS. À la fin de tous les essais, le SMS a confirmé que l’essai choisi était le meilleur. Si l’effet choisi n’était pas le meilleur et qu’il était inacceptable pour des raisons techniques ou de procédures, le SMS a sélectionné un autre essai comme étant « le meilleur ».
- Tous les essais ont été sauvegardés, et si moins de trois essais ont été effectués, le SMS a indiqué la raison.
| Ajustement racial | Origine raciale déclarée | Facteur de correction | |
|---|---|---|---|
| selon l’équation de Corey | selon l’équation de Hankinson | ||
| <1> Blanc | Blanc | Aucun | Aucun |
| Arabe | |||
| Autochtone | |||
| <2> Noir | Noir | Diminution de 10 % de l’équation utilisée pour les blancs | Aucun |
| <3> Hispanique | Mexicain-américain | Aucun | Aucun |
| <4> Asiatique | Asiatique du sud / Asiatique du sud-est | Diminution de 10 % de l’équation utilisée pour les blancs | Diminution de 10 % de l’équation utilisée pour les blancs |
| Asiatique de l’ouest | |||
| Chinois | |||
| Japonais | |||
| Coréen | |||
| Philippin | |||
| <5>Autre | Autre | Aucun | Aucun |
| Inconnu | |||
3.5 Évaluation de la qualité d’un essai
Deux types d’évaluations de critères ont été appliqués pour que le SMS accepte l’essai : les critères pendant l’essai et les critères entre les essais.
3.5.1 Critères pendant l’essai
Les critères pendant l’essai incluent deux critères différents. Tout d’abord, le SMS a dû décider si l’essai était utilisable; le cas échéant, il a dû décider s’il était acceptable à partir des éléments suivants :
Essais utilisables
Pour être utilisable, l’essai devait :
- Comporter un bon départ, c’est‑à‑dire pas trop d’hésitations ou de faux départs. Le volume extrapolé (VE) ne devait pas être supérieur à 0,5 % de la CVF ou 0,150 litre, selon la plus élevée de ces deux valeurs. Le VE découle de l’extrapolation de la partie la plus prononcée de la courbe, lorsque le débit correspond au débit expiratoire de pointe (DEP). CVF= 4,291 L; VE = 0,123 L (2,9 % de la CVF)5.
- Être exempt de quinte de toux pendant la première seconde de l’essai, ce qui aurait affecté la valeur mesurée du VEMS, ou de toute autre quinte de toux qui, de l’avis du SMS, aurait interféré avec l’obtention de résultats précis.
Essais acceptables
Pour être acceptable, l’essai devait répondre à toutes les conditions énoncées précédemment (être utilisable), mais aussi :
- Ne pas comporter de fermeture de la glotte (manœuvre de Valsalva) ou d’hésitations qui auraient pu interrompre le débit d’air. Cela aurait pu être perçu comme un plateau abrupt dans la courbe volume‑temps et une diminution abrupte du débit à la fin de l’essai sur la courbe débit‑volume.
- Ne pas avoir été interrompu de façon prématurée, c’est‑à‑dire qu’il était évident que le répondant n’avait pas été en mesure d’expirer pendant six secondes (ou trois secondes pour les enfants de 6 à 10 ans) et qu’il n’y avait pas de plateau d’une seconde sur la courbe volume‑temps.
- Ne pas comporter de fuites pouvant être perçues comme une perte de volume pendant l’expiration de six secondes sur la courbe volume‑temps, ou même un débit légèrement négatif à la fin de l’expiration.
- Ne pas comporter d’obstruction (p. ex. obstruction attribuable au fait que la langue ou les dents étaient placées devant l’embout buccal ou à une déformation de l’embout buccal (morsure)).
- Ne pas montrer qu’une inspiration additionnelle avait été faite pendant l’essai5.
- Avoir eu de bons départs :
- Volume extrapolé de 0,5% de la CVF ou 0,15 L, selon le plus élevé de ces chiffres (se reporter au point a dans la section « Essais utilisables »).
- La courbe débit‑volume comporte une « bonne pointe » (le délai avant le débit de pointe est inférieur à 120 ms).
- Comporter une expiration satisfaisante :
- Aucune interruption prématurée (se reporter au point d dans cette section).
ou
- Aucune interruption prématurée (se reporter au point d dans cette section).
- Plateau dans la courbe volume‑temps [V(t)].
- Répondant qui ne pouvait plus ou ne devait plus continuer à expirer.
- Effort maximal tout au long de l’essai.
3.5.2 Évaluation de la qualité d’un essai :
Les critères entre les essais ont été utilisés pour évaluer la reproductibilité entre les essais. Lorsque trois spirogrammes acceptables et utilisables ont été obtenus, le SMS a vérifié la reproductibilité entre les essais.
- Si la CVF du répondant était > 1,0 L, les critères de reproductibilité étaient les suivants :
- Les deux CVF les plus importantes se situaient à ≤ 150 ml l’une de l’autre.
- Les deux VEMS les plus importants se situaient à ≤ 150 ml l’un de l’autre.
- Si la CVF du répondant était ≤ 1,0 L, les critères de reproductibilité étaient les suivants :
- Les deux CVF les plus importantes se situaient à ≤ 100 ml l’une de l’autre.
- Les deux VEMS les plus importants se situaient à ≤ 100 ml l’un de l’autre.
- Si, après trois essais, les deux critères étaient respectés, le SMS a poursuivi l’essai jusqu’à ce qu’il :
- soit certain que les trois essais étaient acceptables;
- soit certain que deux des essais étaient reproductibles.
- Si, après trois essais, les deux critères n’étaient pas respectés, le SMS a poursuivi les essais jusqu’à ce que :
- les deux critères soient respectés et les spirogrammes acceptables additionnels soient analysés;
ou
- huit essais au total soient effectués;
- le patient/sujet ne puisse ou ne doive plus continuer5.
ou
Nota : Un répondant pouvait donner un effort utilisable, acceptable et reproductible sans donner son effort maximal. Le SMS a tenté de s’assurer que le répondant faisait un effort maximal pour souffler aussi fort qu’il le pouvait et pour aussi longtemps qu’il le pouvait (p. ex. expression faciale, langage corporel, etc.). Même si les critères d’acceptabilité et de reproductibilité étaient respectés après trois essais, il était fortement conseillé de faire un ou deux essais de plus, particulièrement si le répondant s’améliorait après chaque essai. Il y a une courbe d’apprentissage lors de l’exécution de la spirométrie et les répondants s’améliorent souvent d’essai en essai.
3.6 Évaluation de la qualité des données
Un spécialiste de la spirométrie a effectué un contrôle de la qualité de toutes les données de spirométrie avant que les résultats ne soient communiqués aux répondants et que les données ne soient diffusées. L’examen a comporté une évaluation de tous les essais afin de déterminer l’acceptabilité des essais en de vérifier la reproductibilité et la qualité des tests.
3.6.1 Acceptabilité des essais
Tous les essais ont reçu un code d’acceptabilité (1 = acceptable ou 2 = inacceptable). Seules les courbes acceptables ont été utilisées pour déterminer les meilleures données des tests. Un essai était codé comme inacceptable si les anomalies suivantes ont été relevées :
- le sujet avait toussé pendant la première seconde de l’essai;
- une hésitation excessive a causé un important volume extrapolé;
- l’examinateur a noté que certaines données des tests pourraient nuire à la précision des meilleures données ou des variables dérivées (par exemple, un essai peut présenter la FVC la plus élevée, mais le contrôleur de la qualité peut juger que les données de fin de test ne sont pas fiables);
- l’examinateur a noté que l’ensemble de l’essai était de qualité insuffisante pour que les données soient utilisées en analyse.
3.6.2 Reproductibilité et qualité des tests
On a examiné tous les essais acceptables pour déterminer si les résultats FVC et FEV1 représentaient un effort maximal par le répondant (qualité) et satisfaisaient au critère de reproductibilité de 150 ml. Les facteurs qualitatifs FVC (SPM_QFVC) et FEV1 (SPM_QV1) montrent si une FVC et/ou une FEV1 reproductibles ont été obtenues.A : Reproductibilité et qualité excellentes; à utiliser en analyse.
B : Reproductibilité et qualité satisfaisantes; à utiliser en analyse.
Exemple : Il arrive souvent que la durée des expirations des enfants ou des adolescents n’est pas suffisamment longue (la durée devrait être de trois 3 ou de 6 secondes). Si les essais d’un répondant montrent un plateau à 1 seconde et que l’examinateur juge que les courbes représentent un volume maximal (FVC), un code B est attribué.
C : Reproductibilité et qualité douteuses; à utiliser avec prudence en analyse.
Exemple : Le répondant n’a que deux courbes acceptables, mais non reproductibles, et les autres courbes sont inacceptables en raison d’une durée d’expiration trop courte et de grands volumes extrapolés. Toutefois, les courbes ayant de grands volumes extrapolés se trouvent à confirmer la reproductibilité de la FVC.
Exemple : Dans le cas d’un répondant souffrant de bronchopneumopathie obstructive chronique (BPOC) et présentant de faibles valeurs FEV1 et FVC (p. ex. moins de 0,45), la BPOC fait en sorte que le répondant ne peut fournir de FVC reproductible même après huit manœuvres. Le code à attribuer devrait être au moins un C, l’absence de courbe acceptable par anomalie des données de fin de test n’étant pas un motif suffisant pour exclure le sujet ou lui attribuer un D ou un F.
D : Reproductibilité et qualité hautement douteuses; à ne pas utiliser en analyse.
F : Résultats de test inacceptables; à ne pas utiliser en analyse.
4. Aptitudes musculosquelettiques
4.1 Composante de la force de préhension
Par force musculaire, on entend la force maximale qui peut être générée par un muscle ou un groupe de muscles particulier. La façon la plus courante de mesurer la force musculaire sur le terrain consiste à mesurer la force de préhension isométrique, grâce à un dynamomètre à main. Le protocole de la composante de la force de préhension est fondé sur le Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller )1 pour les adultes de 15 à 69 ans et sur l’Enquête condition physique Canada de 19812 pour les enfants de 7 à 14 ans.
4.1.1 Équipement
- Dynamomètre à main Smedley III (Takei Scientific Instruments, poignée A).
4.1.2 Admissibilité
- Les répondants de 6 à 79 ans.
4.1.3 Critères d’exclusion
- Répondants qui ont donné des réponses positives aux questions 5, 6 et 7 du Q‑AAP (selon les questions d’approfondissement posées par le SMS) (voir l’annexe 3).
- Répondants dont la fonction des membres supérieurs était limitée – les répondants incapables de tenir le dynamomètre avec l’une ou l’autre des deux mains (p. ex. doigts manquants sur les deux mains, paralysie des deux mains) ont été exclus. Les répondants aptes à tenir le dynamomètre avec une des deux mains devaient compléter la composante.
4.1.4 Administration de la composante de la force de préhension
-
Le SMS a fait une démonstration de la technique appropriée, en soulignant que le répondant ne devait pas retenir son souffle en faisant le test (éviter la manœuvre Valsalva). Le répondant devait enlever tous les bijoux portés aux mains et aux poignets.
-
Le répondant devait tenir le dynamomètre dans sa main droite, entre les doigts et la paume à la base du pouce.
-
La taille de la poignée du dynamomètre a été ajustée à l’aide de la vis, de sorte que les deuxièmes jointures des doigts puissent être en contact avec la poignée et supporter le poids de l’instrument.
-
Le répondant devait tenir le dynamomètre à la hauteur de la cuisse en ayant le bras tendu et éloigné du corps à un angle de 45°. Il devait se tenir droit, détendu, les pieds à la largeur des épaules. Durant le test, ni la main du répondant, ni le dynamomètre, ne devaient toucher au corps ou à tout autre objet.
-
Le répondant a dû alors serrer vigoureusement l’instrument, au maximum de sa force, en expirant pendant qu’il serrait pour éviter une hausse de tension intrathoracique.
-
Le dynamomètre a été remis à zéro et le test a été repris avec la main gauche. Les deux mains ont été mesurées deux fois, en alternance.
-
Les résultats ont été enregistrés pour chaque main, au kilogramme près.
4.2 Composante de la flexion du tronc
Le protocole pour la composante de la flexion du tronc est fondé sur le Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller )1 pour les adultes de 15 à 69 ans et sur l’Enquête condition physique Canada de 19812 pour les enfants de 7 à 14 ans.
4.2.1 Équipement
- Tapis d’exercices.
- Flexomètre.
4.2.2 Admissibilité
- Les répondants de 6 à 69 ans.
4.2.3 Critères d’exclusion
- Répondants qui ont donné des réponses positives aux questions 5 et 7 du Q‑AAP (selon les questions d’approfondissement posées) (voir l’annexe 3).
- Femmes enceintes (> 12 semaines).
- Répondants de 70 ans et plus.
- Poche pour colostomie.
- Répondants dont les membres inférieurs sont paralysés.
- Visite à domicile.
4.2.4 Administration de la composante de la flexion du tronc
-
Les répondants ont dû se déchausser pour faire ce test et faire au préalable quelques étirements de réchauffement. Le mouvement a été démontré avant que le répondant doive l’exécuter.
-
Le répondant devait s’asseoir par terre, les jambes complètement étendues devant lui et la plante des pieds contre le flexomètre. La face interne de chaque plante de pied devait être à une distance de six pouces. Le flexomètre devait être bien appuyé contre le mur.
-
Le répondant devait se pencher doucement en avant, sans faire de mouvement brusque, en gardant les genoux bien droits, les bras bien étendus devant lui, les paumes vers le sol et les mains superposées et pousser la glissière le long de l’échelle avec le bout des doigts. Le bout des doigts d’une main ne devait pas dépasser le bout des doigts de l’autre main.
-
Le répondant devait maintenir la position de flexion maximale pendant environ deux secondes. On a expliqué au répondant qu’il pourrait atteindre une plus grande distance s’il baissait la tête et s’il expirait.
-
Si les genoux du répondant étaient fléchis, l’essai ne comptait pas. Les mouvements saccadés ou brusques n’étaient pas autorisés.
-
Le test a été exécuté deux fois, avec un bref repos entre les essais. La distance maximale atteinte à la fin de chaque essai a été enregistrée au 0,1 cm près.
4.3 Composante des redressements assis partiels
Le protocole pour la composante des redressements assis partiels est fondé sur le Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller )1.
4.3.1 Équipement
- Tapis d’exercices avec bande de métal de 10 cm à une extrémité.
- Goniomètre.
- Métronome.
4.3.2 Admissibilité
- Les répondants de 6 à 69 ans.
4.3.3 Critères d’exclusion
- Répondants qui ont donné des réponses positives aux questions 1, 2, 3 (automatiques) et 5, 6 et 7 du Q‑AAP (selon les questions d’approfondissement posées) (voir l’annexe 3).
- Femmes enceintes (> 12 semaines).
- Répondants de 70 ans et plus.
- Répondants dont la fréquence cardiaque au repos est > 100 bpm ou dont la tension artérielle au repos est > 144/94 mmHg, tel que déterminé durant la composante de la tension artérielle.
- Personnes ayant une incapacité mentale ou physique (à la discrétion du SMS).
- Difficulté respiratoire au repos.
- Toux persistante.
- Membres inférieurs enflés.
- Semble malade ou se plaint de fièvre.
- Poche pour colostomie.
- Visite à domicile.
4.3.4 Administration de la composante des redressements assis partiels
-
La position appropriée pour la composante des redressements assis partiels a d’abord été démontrée au répondant par le SMS.
-
Le répondant devait se mettre en position de départ de la façon suivante.
- Le répondant devait être couché sur le dos, la tête sur le tapis, les épaules détendues, les bras bien étendus le long du corps et parallèles au tronc, la paume des mains en contact avec le tapis et le bout du majeur de chaque main, lorsqu’elles sont en extension complète, touchant le bord inférieur de la bande de métal (c.‑à‑d. le bord le plus près). Si le répondant avait un bras plus long que l’autre, le bord intérieur de la bande de métal devait être placé au niveau du majeur du bras le plus long.
- Les jambes du répondant devaient être écartées à la largeur des épaules et pliées à un angle de 90° (le goniomètre a été utilisé pour s’assurer que l’angle était correct).
- Les talons du répondant devaient demeurer en contact avec le sol. Le répondant devait garder ses souliers. Si le répondant n’avait pas de chaussures appropriées, il a pu faire le test déchaussé.
- Action :
- Le métronome a été réglé à 50 battements par minute. Le SMS était autorisé à dire « monter sur un temps, descendre sur un temps » durant le test si le répondant avait de la difficulté à suivre la cadence du métronome.
- Le répondant devait se redresser lentement jusqu’à ce que le bout du majeur de chaque main atteigne le bord extérieur de la bande de métal.
- On a expliqué au répondant que ses doigts devaient rester en contact avec la bande de métal et ses talons en contact avec le sol. Il n’était pas permis de fixer les pieds au sol.
- En phase descendante, le répondant devait garder ses omoplates et sa tête en contact avec le tapis et le bout du majeur de chaque main devait toucher le bord intérieur de la bande de métal.
- Le mouvement devait être exécuté lentement, de façon contrôlée, à une cadence de 25 redressements assis par minute (se redresser sur un temps, redescendre sur un temps).
- Le répondant devait exécuter le plus grand nombre de redressements assis partiels d’affilée possibles, sans s’arrêter, jusqu’à un maximum de 25 redressements assis partiels en une minute.
- Seuls les redressements assis exécutés selon la bonne technique ont été comptés. Des indications ont été fournies concernant les redressements mal exécutés.
- On a terminé le test avant qu’une minute ne soit écoulée si le répondant :
- ressentait un inconfort excessif;
- ne pouvait pas maintenir la cadence exigée;
- ne pouvait pas maintenir la technique de redressement assis partiel appropriée (p. ex. les talons ne restaient pas en contact avec le sol) pendant deux répétitions consécutives, malgré la correction de l’exécution par le SMS.
Nota : La même erreur devait être répétée deux fois de suite pour que le test prenne fin. Si le répondant faisait consécutivement deux erreurs différentes, le test continuait jusqu’à ce qu’il fasse deux fois de suite la même erreur ou jusqu’à ce qu’il ait exécuté les 25 redressements assis partiels. - Le nombre de redressements assis partiels complétés a été enregistré. Les redressements incorrects n’ont pas été enregistrés.
5. Physitest aérobie canadien modifié (PACm)
Le protocole de la composante Physitest aérobie canadien modifié (PACm) est fondé sur le Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller )1 pour les adultes de 15 à 69 ans et sur l’Enquête condition physique Canada de 19812 pour les enfants de 6 à 14 ans.
5.1 Équipement
- Brassard de tensiomètre automatisé BpTRU™ (de différentes tailles).
- Escalier du PACm.
- CD du PACm.
- Lecteur de CD.
- Chronomètre.
- Métronome (facultatif).
- Stéthoscope (facultatif).
- Moniteur de fréquence cardiaque (ceinture, sangle, montre).
- Sphygmomanomètre au mercure (facultatif).
5.2 Admissibilité
- Tous les répondants de 6 à 69 ans.
5.3 Critères d’exclusion
- Réponses positives aux questions 1, 2, 3 ou 6 (automatiques) ou aux questions 4, 5 ou 7 du Q‑AAP (selon les questions d’approfondissement posées) (voir l’annexe 3).
- Répondants qui prennent des médicaments qui modifient la fréquence cardiaque ou la tension artérielle.
- Femmes enceintes (> 12 semaines).
- Répondants de 15 ans et plus dont la fréquence cardiaque au repos est > 99 bpm ou la tension artérielle au repos est > 144/94 mmHg, tel que déterminé durant la composante de sélection.
- Personnes ayant une incapacité mentale ou physique, à la discrétion du SMS. Il faut tâcher dans toute la mesure du possible d’inclure les personnes ayant une incapacité, à condition de prendre toutes les précautions de sécurité.
- Don de sang au cours des 24 dernières heures.
- Difficulté respiratoire au repos.
- Répondants qui prennent des médicaments pour un problème respiratoire qui empire durant l’exercice, mais qui n’ont pas apporté leurs médicaments (tel qu’évalué durant la composante de sélection).
- Semble malade ou se plaint de fièvre.
- Toux persistante.
- Membres inférieurs enflés.
- Pompe à insuline.
- Oxygène d’appoint.
- Boisson alcoolisée consommée depuis minuit (dépendant à la quantité).
- Gros repas dans l’heure qui a précédé le rendez-vous au centre d’examen mobile.
- Visite à domicile.
5.4 Administration du PACm
-
Le spécialiste des mesures de la santé (SMS) a demandé à tous les répondants s’ils avaient besoin d’aller aux toilettes avant de commencer le test.
-
Le SMS a expliqué le test et a aidé le répondant à mettre le moniteur de fréquence cardiaque. La sangle a été ajustée de manière à obtenir un bon résultat. Le SMS s’est assuré que la température de la salle se situait autour de 21°C ± 2°C.
-
Le SMS a fait une démonstration de l’exercice de l’escalier en deux étapes, d’abord sans musique, puis avec la musique réglée au niveau du premier palier d’exercice du répondant. Chaque répondant a commencé l’exercice à une intensité d’environ 65 à 70 % de la puissance aérobie moyenne prévue pour une personne de 10 ans plus âgée que lui. Les répondants de sexe masculin de 15 à 69 ans ont utilisé deux marches pour les paliers 1 à 6 et une marche pour les paliers 7 et 8. Les répondantes de sexe féminin de 15 à 69 ans ont utilisé une marche pour le palier 8 seulement. Tous les paliers d’exercice pour les répondants de 6 à 14 ans ont été faits en utilisant deux marches et la musique a toujours été celle de la femme adulte (selon le protocole de l’Enquête condition physique Canada de 1981)2. Le palier de départ était le palier 5, quel que soit le sexe du répondant. Si le répondant a achevé le septième palier, on a arrêté le test, que le répondant ait atteint sa fréquence cardiaque limite ou non. En pareil cas, la fréquence cardiaque du répondant à la fin du palier 7 a servi à déterminer son niveau de capacité.
-
Le SMS a demandé au répondant d’essayer de faire l’exercice à deux paliers avec la musique. Le SMS a ensuite démontré au répondant comment effectuer l’exercice à un palier. Si la fréquence cardiaque du répondant après l’essai de l’exercice à deux paliers était inférieure à 100 bpm, le SMS a demandé au répondant d’essayer de faire l’exercice à un palier. Si la fréquence cardiaque du répondant était supérieure à 100 bpm avant de commencer le test, le SMS a demandé au répondant de se reposer avant de commencer le test. On a rappelé au répondant que chaque palier d’exercice durait trois minutes et lorsque la musique s’arrêtait, il devait s’arrêter, se tourner vers le SMS et rester immobile. On a informé les répondants de ne pas parler durant le PACm, à moins que cela soit nécessaire.
-
Le SMS a commencé le test au palier de départ prédéterminé. Il a guidé le répondant s’il éprouvait de la difficulté à maintenir la cadence. Durant le test, le SMS est demeuré près du répondant pour repérer tout signe d’inconfort. Le test a été arrêté immédiatement si le répondant commençait à chanceler, se plaignait d’étourdissements, ressentait une forte douleur aux jambes, avait des nausées, des douleurs à la poitrine ou s’il pâlissait.
- À la fin de chaque étape, le répondant devait s’interrompre, se tourner vers le SMS et demeurer immobile. Le SMS a pris la fréquence cardiaque indiquée sur le moniteur lorsque l’instructeur enregistré sur le CD disait « INTERROMPRE L’EXERCICE ». Cette valeur a été enregistrée dans l’application de saisie des données.
Nota : Si le SMS ne pouvait pas obtenir une mesure de la fréquence cardiaque à l’aide du moniteur, il a dû la mesurer manuellement, au moyen du stéthoscope. Le SMS a placé la tête du stéthoscope près du sternum au deuxième espace intercostal. Le SMS a pris le pouls pendant 10 secondes.
-
Si la fréquence cardiaque du répondant était inférieure à sa fréquence cardiaque limite prédéterminée, le SMS lui a demandé de se préparer à faire le palier suivant. Si sa fréquence cardiaque était égale ou supérieure à sa fréquence cardiaque limite prédéterminée, l’exercice de l’escalier comme tel s’est terminé. Si le répondant a atteint sa fréquence cardiaque limite prédéterminée pendant le test, il a dû terminer les trois minutes du palier. Dès que la partie du palier a été complète, le SMS a arrêté le chronomètre et est passé aux procédures post‑test.
Nota : Si un répondant était incapable de faire un palier jusqu’au bout, il a fallu enregistrer la raison pour laquelle il était incapable de le faire. On a contrôlé la fréquence cardiaque et la tension artérielle post‑exercice dans ces cas.
Nota : Si un répondant a été incapable de faire un palier jusqu’au bout, la raison pour laquelle il n’a pu le faire a été enregistrée. La fréquence cardiaque et la tension artérielle post‑exercice ont été contrôlées dans ces cas.
| Touche | Raison | Quand choisir cette réponse |
|---|---|---|
| 1 | Refus | Le répondant refuse de participer |
| 2 | Incapable de suivre la cadence | Le répondant ne peut faire le test à la cadence appropriée |
| 3 | Étourdissement | Le répondant se sent étourdi |
| 4 | Extrêmes douleurs aux jambes | Le répondant ne peut continuer ou commencer le test à cause de douleurs aux jambes (accumulation d’acide lactique, blessure, arthrite…) |
| 5 | Nausée | Le répondant a mal au cœur ou a un mal de tête extrême |
| 6 | Douleurs à la poitrine | Le répondant ressent des douleurs à la poitrine |
| 7 | Pâleur faciale | Le répondant semble être malade |
| 8 | Autre – Veuillez préciser | Toute autre raison non mentionnée ci-dessus. Le système vous invitera à fournir une explication de cette raison dans un encadré. |
5.5 Procédures post-test
-
Une fois le dernier palier achevé, on a demandé au répondant de marcher lentement dans la pièce pendant 1,5 minute. Le cardiofréquencemètre a été enlevé du répondant. Si le répondant semblait trop fatigué ou était étourdi à la fin du test, le SMS lui a demandé de s’asseoir et de surélever ses jambes.
-
Après 1,5 minute, on a demandé au répondant de s’asseoir.
-
La tension artérielle du répondant a été prise (électroniquement ou manuellement) 2 minutes après l’exercice et 3,5 minutes après l’exercice. Ces mesures ont été enregistrées.
-
Si la tension artérielle du répondant à 3,30 minutes était > 144/94 mmHg et que sa fréquence cardiaque était > 99 bpm, le SMS a continué de mesurer la tension artérielle et la fréquence cardiaque à des intervalles de deux minutes, jusqu’à ce qu’elles soient inférieures à 145/95 mmHg et 100 bpm.
6. Composante de la santé bucco-dentaire
Un manuel d’enquête du dentiste a été conçu pour recueillir les données nécessaires pour évaluer l’état de santé bucco‑dentaire des Canadiens et est fondé sur les critères de l’Organisation mondiale de la santé (OMS). Les réponses à l’enquête ont été entrées directement à l’ordinateur. On a utilisé le système de numérotation de la Fédération dentaire internationale (FDI). Le manuel d’enquête du dentiste comportait quatre blocs : Introduction à la composante de la santé bucco‑dentaire, Questions sur la santé bucco‑dentaire, Restrictions concernant l’examen bucco‑dentaire et Examen bucco‑dentaire. Pour plus de renseignements, voir le Manuel de l’enquête et critères de codage à l’intention du dentiste de l’Enquête canadienne sur les mesures de la santé 2007 à 2009.
6.1 Équipement
- Miroir plan.
- Sonde parodontale graduée Williams.
- Rouleaux de coton hydrophile et gaze.
6.2 Admissibilité
- Tous les répondants de 6 à 79 ans
6.3 Critères d’exclusion
Les critères suivants ont servi à exclure les répondants de la partie de la mesure de la poche parodontale de l’examen bucco‑dentaire.
- Répondants qui doivent prendre des antibiotiques (p. ex. de la pénicilline) avant de subir un examen dentaire ou de recevoir des soins dentaires.
- Répondants chez qui un professionnel de la santé a déjà diagnostiqué un souffle cardiaque qui fait qu’ils doivent prendre des antibiotiques lorsqu’ils reçoivent un traitement dentaire.
- Répondants chez qui un professionnel de la santé a diagnostiqué un problème de valve cardiaque.
- Répondants chez qui un professionnel de la santé a diagnostiqué une maladie du cœur congénitale.
- Répondants chez qui un professionnel de la santé a diagnostiqué une endocardite bactérienne.
- Répondants chez qui un professionnel de la santé a diagnostiqué un rhumatisme articulaire aigu.
- Répondants qui ont subi un pontage au cours de la dernière année.
- Répondants qui ont un stimulateur cardiaque ou un autre défibrillateur automatique depuis moins d’un an.
- Répondants qui ont d’autres matériaux artificiels au niveau du cœur, des veines ou des artères.
- Répondants qui ont subi un remplacement d’articulation.
- Répondants qui ont déjà subi une transplantation d’organe.
- Répondants qui ont une maladie rénale qui exige la dialyse.
- Répondants dont le système immunitaire est déficient ou qui suivent un traitement immunosuppresseur (p.ex. chimiothérapie).
- Répondants qui sont hémophiles ou qui ont subi de la chimiothérapie au cours des quatre dernières années.
6.4 Administration de la composante de la santé bucco‑dentaire
Bloc des questions sur la santé bucco‑dentaire (OHQ)
- Par la suite, le dentiste a posé une série de questions concernant la santé bucco‑dentaire du répondant. Ces questions viennent compléter le bloc d’examen et contribuent à établir un meilleur profil du répondant. Au cours de cette composante, l’assistant dentaire pour l’enregistrement des données a inscrit les réponses fournies par le répondant dans l’application de saisie des données.
Bloc des restrictions concernant l’examen bucco‑dentaire (OHR)
-
Avant le bloc de l’examen bucco‑dentaire, le dentiste a posé des questions particulières de sélection, afin de déterminer si le répondant pouvait participer à l’ensemble de la composante de la santé bucco‑dentaire.
-
Au cours de cette composante, l’assistant dentaire chargé de l’enregistrement des données a entré les réponses fournies par le répondant dans l’application de saisie des données.
- Si le répondant a répondu oui à l’une ou l’autre des questions de restriction (sauf la question sur le stimulateur cardiaque et les autres défibrillateurs, qui comporte une question d’approfondissement), le bloc des restrictions concernant la santé bucco‑dentaire a pris fin et le répondant a automatiquement été exclu de la partie de la mesure de la poche parodontale de l’examen bucco‑dentaire. Tous les répondants qui souffraient d’hémophilie et qui avaient eu de la chimiothérapie au cours des quatre dernières semaines ont été exclus de ce bloc de questions complètement, étant donné qu’ils avaient été exclus automatiquement de l’examen en raison de ce problème de santé.
Bloc de l’examen bucco‑dentaire (OHE)
-
Au début du bloc de l’examen bucco‑dentaire, le dentiste a expliqué le processus au répondant et lui a montré les instruments devant être utilisés pendant l’examen.
-
Au fur et à mesure que le dentiste est passé d’une question à l’autre, l’assistant dentaire responsable de l’entrée des données lui a indiqué ce qui venait ensuite et, au besoin, le numéro de la dent par laquelle le dentiste devait commencer. Cela était important, le déroulement de l’examen dentaire variant d’une question à l’autre et les indices fournis par l’assistant dentaire contribuant à limiter les erreurs.
- Le bloc d’examen dentaire a permis d’évaluer ce qui suit :
- État dentaire – Cette section a permis de saisir l’état des dents naturelles du répondant.
- État prothétique – Cette section a permis de déterminer la présence de dents artificielles au maxillaire supérieur ou inférieur du répondant. Le dentiste devait demander au répondant si ce dernier avait des prothèses, même s’il ne les portait pas.
- État des muqueuses – Cette section a permis de saisir la présence ou l’absence de toute pathologie buccale. Une pathologie buccale désigne toute anomalie de la cavité buccale.
- Fluorose – Cette section a permis de saisir le niveau de fluorose des incisives antérieures permanentes des répondants de 6 à 12 ans.
- État/traitement orthodontique – Cette section a permis de saisir l’état et le traitement orthodontiques des répondants de plus de 12 ans. Dans le cas d’un répondant édenté, l’application a sauté cette série de questions.
- Examens périodontiques – Ces examens visent la gingivite, les débris, le calcul, la perte d’attachement et la poche parodontale. L’âge du répondant et les antécédents médicaux déjà saisis (bloc OHR, hémophilie, chimiothérapie) ont déterminé si le répondant pouvait participer à l’examen de la perte d’attachement et de la poche parodontale. Dans le cas des répondants de moins de 15 ans ou de ceux qui n’avaient pas la condition médicale pour subir l’examen de la perte d’attachement et de la poche parodontale ou l’examen du tartre sous‑gingival, les parties de la « perte d’attachement » et de la « poche parodontale » de cette section ont été sautées.
- État des dents – Cette section a permis de saisir l’état de chaque dent du répondant. Pour les répondants de 17 ans ou moins, le dentiste n’a pas examiné les racines. Dans le cas d’un enfant ayant une dentition mixte (dents de lait et dents permanentes), l’état des dents présentes dans la bouche a été enregistré. En présence de dents de lait et de dents permanentes, les dents permanentes ont eu préséance.
- Nombre de faces dentaires obturées avec des amalgames – Cette section a permis de saisir le nombre total de faces dentaires obturées avec des amalgames (argent).
- Lésion traumatique – Cette section a permis de saisir l’état de chacune des quatre incisives permanentes supérieures et des quatre incisives permanentes inférieures.
- Nécessité d’un traitement – Cette section a permis de saisir l’opinion du dentiste au sujet du traitement dont avait immédiatement besoin le répondant, en présumant qu’il n’y avait aucune restriction financière. Il pouvait s’agir d’un traitement prothétique ou général.
- Nécessité d’un traitement urgent – Lorsque le répondant a quitté la salle d’examen bucco‑dentaire, le dentiste a rempli la section des « besoins urgents » de la composante.
- Constatation d’un problème médical – Si le dentiste a remarqué, pendant l’examen, que le répondant présentait une lésion buccale, une infection aiguë grave ou un autre problème grave qui nécessitait une intervention immédiate (en moins d’une semaine) d’un médecin, il a dû l’enregistrer.
7. Composante de la collecte d’échantillons d’urine
L’objectif de la composante de la collecte d’échantillons d’urine était d’obtenir, pour les participants à l’enquête de 6 à 79 ans, des résultats de laboratoire sur divers paramètres qui seront utilisés pour estimer la prévalence de maladies et de facteurs de risque de maladies, ainsi que pour recueillir des données de base sur l’état de santé de la population, l’état nutritionnel et l’exposition aux contaminants environnementaux.
Environ 70 ml d’urine ont été recueillis auprès de chaque répondant de 6 à 79 ans. La composante de la collecte d’échantillons d’urine pouvait se faire n’importe quand durant la visite à la clinique.
7.1 Critères d’exclusion
- Incapacité mentale ou physique empêchant de fournir un échantillon
- Obstacle linguistique important empêchant de donner des instructions appropriées pour la collecte
7.2 Matériel
- Contenant d’urine
7.3 Collecte d’échantillons d’urine
| 1. | Lavez‑vous les mains à l’eau et au savon. |
| 2. | Ouvrez le contenant d’urine. Ne touchez pas l’intérieur du contenant ni du couvercle. |
| 3. | Laissez s’écouler une petite quantité d’urine dans la cuvette puis, sans vous arrêter, recueillez autant d’urine que possible dans le contenant. Dans la mesure du possible, remplissez-le d’urine jusqu’à la ligne noire. |
| 4. | Fermez hermétiquement le contenant au moyen du couvercle en veillant à ne pas toucher les bords intérieurs du contenant. Rincez le contenant et essuyez-le. Placez-le ensuite dans le sac en papier brun qui vous a été fourni. |
| 5. | Lavez‑vous les mains à l’eau et au savon |
| 6. | Remettez le contenant d’urine dans le sac en papier brun au membre du personnel de l’ECMS. |
Nota : À l’occasion, il a fallu obtenir plusieurs échantillons d’urine pour atteindre le volume requis. Plus d’un échantillon d’urine a été nécessaire seulement dans les cas où le premier échantillon d’urine du répondant était inférieur aux trois quarts (¾) du volume requis.
7.4 Manipulation des échantillons d’urine
Dès leur réception, les échantillons d’urine étaient mis au réfrigérateur avec le code à barres placé vers l’avant jusqu’à leur traitement. Lorsqu’un répondant avait fourni plus d’un échantillon d’urine, les deux échantillons étaient combinés dès la réception du deuxième échantillon. Si le temps ne le permettait pas, les contenants devaient être gardés ensemble et étiquetés 1, 2, etc.
7.4.1 Répartition des échantillons d’urine
| Type de tube de prélèvement | ID du test | Nom du test | Âge (années) | Volume souhaité d’échantillon (ml) | Volume minimal d’échantillon (ml) | Capacité du tube d’échantillon (ml) | Type de tube d’échantillon | Couleur du bouchon |
|---|---|---|---|---|---|---|---|---|
| Contenant d’urine | 701 | Microalbumine/ Créatinine |
6 à 79 | 2,0 | 0,5 | 2,0 | VWR Cryogénique | Bleu |
| 751 | Cotinine | 6 à 79 | 4,5 | 0,5 | 5,0 | VWR Cryogénique | Rouge | |
| 752 | Phtalates | 6 à 49 (3 500) |
15,0 | 12,0 | 30,0 | Nalgene | Transparent | |
| 753 | Mercure inorganique | 6 à 79 | 4,5 | 1,6 | 5,0 | VWR Cryogénique | Transparent | |
| 754 | Bisphénol A | 6 à 79 (5 000) |
(voir la note) | 20,0 | 30,0 | Nalgene | Transparent | |
| 702 | Iode | 6 à 79 | 4,0 | 2,0 | 5,0 | VWR Cryogénique | Vert | |
| 755 | Pesticides organophosphorés | 6 à 79 (5 000) |
(voir la note) | Avec le test 754 | 30,0 | Nalgene | Transparent | |
| 756 | Herbicide de type phénoxy | 6 à 79 (5 000) |
(voir la note) | Avec le test 754 | 30,0 | Nalgene | Transparent | |
| 971 | Urine entreposée 1 | 6 à 79 | 4,5 | S.O. | 5,0 | VWR Cryogénique | Jaune | |
| 972 | Urine entreposée 2 | 6 à 79 | 4,5 | S.O. | 5,0 | VWR Cryogénique | Jaune |
Note : Les échantillons pour les tests nos 754, 755 et 756 proviennent tous de la même bouteille de 30 mL.
7.5 Entreposage des échantillons
Les échantillons étaient entreposés dans le réfrigérateur du laboratoire du centre d’examen mobile et étaient expédiés une fois par semaine aux laboratoires de référence. Tous les échantillons étaient entreposés aussitôt que le traitement était terminé.
Pour plus de renseignements concernant les procédures opératoires normalisées du laboratoire, veuillez communiquer avec l'Enquête canadienne sur les mesures de la santé au 1-888-253-1087 ou à chms-ecms@statcan.gc.ca.
8. Composante de la phlébotomie
Pendant la composante de la phlébotomie, le phlébotomiste prélevait des échantillons de sang dans le but d’y analyser l’état nutritionnel, le syndrome métabolique, la maladie cardiovasculaire et les marqueurs de maladies infectieuses.
8.1 Critères d’exclusion
- Chimiothérapie au cours des quatre dernières semaines
- Hémophilie
- Double mastectomie
- Éruption cutanée, pansement de gaze, plâtre, œdème, paralysie, tubes, plaies ouvertes, bras décharnés ou membres amputés, veines lésées, sclérosées ou occluses, allergies aux réactifs de nettoyage, tissu brûlé ou cicatriciel, shunt ou IV dans les deux bras.
8.2 Matériel
| Vacutainer 8,5 ml rouge/gris SST | Bandages/ruban adhésif non allergénique |
| Vacutainer 2,0 ml gris clair | CaviWipes |
| Vacutainer 6,0 ml lavande EDTA | Garrot (jetable et réutilisable) |
| Vacutainer 10,0 ml lavande EDTA | Tampons d’alcool |
| Vacutainer 5,0 ml jaune SST | Compresse de gaze |
| Vacutainer 1,8 ml bleu pâle | Contenant à objets piquants et tranchants |
| Vacutainer 3,0 ml rouge | Gants non stériles, sans latex, tailles : S, M, L, XL, XS |
| Aiguilles de calibre 21 | Désinfectant antibactérien pour les mains |
| Aiguilles de calibre 22 | Virkon/Haztab |
| Aiguilles papillon de calibre 21 | Tampon encreur d’une goutte de sang |
| Aiguilles papillon de calibre 23 | Agitateur basculant pour tubes Vacutainer
|
| Aiguilles papillon de calibre 25 |
8.3 Exécution de la ponction veineuse
8.3.1 Choix de la veine appropriée
Dans la mesure du possible, on cherchait une veine dans le bras gauche en premier.
La veine cubitale médiane et la veine céphalique ont été les plus couramment utilisées pour les ponctions veineuses. S’il ne trouvait aucune veine convenable dans cette région, sur aucun des deux bras, le phlébotomiste cherchait sur le dos de la main. Les veines de la main ont été utilisées en dernier recours, et une aiguille papillon a toujours été utilisée pour cette procédure.
8.3.2 Préparatifs de la prise de sang
-
Le phlébotomiste déterminait le calibre approprié de l’aiguille.
-
Le site de la ponction était nettoyé avec un tampon d’alcool en un mouvement circulaire en commençant au centre et en allant vers l’extérieur.
-
Tout le matériel nécessaire pour la ponction veineuse était préparé et tous les tubes étaient placés dans l’ordre requis (voir tableaux 2a et 2b).
-
Le phlébotomiste appliquait de nouveau le garrot lorsque tout était prêt pour la prise de sang. Il demandait au répondant de serrer la main et de la maintenir fermée. Il demandait également au répondant de ne pas pomper avec la main, car cela aurait pu influer sur certains résultats d’analyse.
| Ordre des tubes | Genre de tube | Grandeur | Âge en année | |||
|---|---|---|---|---|---|---|
| 6 à 11 | 12 et 13 | 14 à 19 | 20 à 79 | |||
| 01 | Rouge/gris SST | 8,5 ml | O | O | O | O |
| 02 | Gris clair | 2,0 ml | O | O | O | O |
| 03 | Lavande EDTA | 6,0 ml | O | O | O | O |
| 04 | Lavande EDTA | 6,0 ml | O | O | O | O |
| 05 | Rouge/gris SST | 8,5 ml | O | O | ||
| 06 | Lavande EDTA | 10,0 ml | O | |||
| 07 | Bleu clair | 1,8 ml | O | O | O | |
| 08 | Jaune SST | 5,0 ml | O | O | O | O |
| 09 | Lavande EDTA | 10,0 ml | O | |||
| 10 | Lavande EDTA | 10,0 ml | O | |||
| 11 | Rouge/gris SST | 8,5 ml | O | O | O | |
| Ordre des tubes | Genre de tube | Grandeur | Âge en année | |||
|---|---|---|---|---|---|---|
| 6 à 11 | 12 et 13 | 14 à 19 | 20 à 79 | |||
| 01 | Rouge/gris SST | 8,5 ml | O | O | O | O |
| 02 | Lavande EDTA | 6,0 ml | O | O | O | O |
| 03 | Lavande EDTA | 6,0 ml | O | O | O | O |
| 04 | Rouge/gris SST | 8,5 ml | O | O | ||
| 05 | Gris clair | 2,0 ml | O | O | O | O |
| 06 | Lavande EDTA | 10,0 ml | O | |||
| 07 | Bleu clair | 1,8 ml | O | O | O | |
| 08 | Jaune SST | 5,0 ml | O | O | O | O |
| 09 | Lavande EDTA | 10,0 ml | O | |||
| 10 | Lavande EDTA | 10,0 ml | O | |||
| 11 | Rouge/gris SST | 8,5 ml | O | O | O | |
8.4 Manipulation des échantillons sanguins
Le phlébotomiste apportait les échantillons de sang dans le laboratoire aussitôt que possible après leur prélèvement.
| Temps/moment | Type de tube (ordre du tube) | Manipulation |
| Durant les 15 premières minutes après le prélèvement |
6,0 ml EDTA lavande (03 ou 02)1 6,0 ml EDTA lavande (04 ou 03)1 2,0 ml gris clair (02 ou 05)1 10,0 ml EDTA lavande (06) 1,8 ml bleu clair (07) 10,0 ml EDTA lavande (09 et 10) |
Placer sur l’agitateur |
| 8,5 ml rouge/gris (01) 8,5 ml rouge/gris (05 ou 04)1 5,0 ml jaune SST (08) 8,5 ml rouge/gris (11) 3,0 ml rouge (99) |
Laisser dans le support pour tubes de prélèvement à la température ambiante | |
| Après les 15 premières minutes | 8,5 ml rouge/gris (01) 8,5 ml rouge/gris (05 ou 04)1 5,0 ml jaune SST (08) 8,5 ml rouge/gris (11) |
Régler le minuteur à 15 minutes. Laisser les tubes dans le support à la température ambiante pour leur permettre de coaguler |
| 10,0 ml EDTA lavande (09 et 10) | Enrober les bouchons d’un film de paraffine et placer les tubes au réfrigérateur dans le support désigné pour l’ADN | |
| 6,0 ml EDTA lavande (03 ou 02) 3,0 ml rouge (99) |
Transférer une aliquote de 1,5 ml dans le tube à bouchon rouge de 3,0 ml . Placer le tube de 6,0 ml sur le support dans le réfrigérateur |
|
| 6,0 ml EDTA lavande (04 ou 03)1 2,0 ml gris clair (02 ou 05) 10,0 ml EDTA lavande (06) 1,8 ml bleu clair (07) |
Placer les tubes ensemble dans le réfrigérateur sur un support | |
| Après la deuxième période de 15 minutes |
6,0 ml EDTA lavande (03 ou 04)1 2,0 ml gris clair (02 ou 05)1 10,0 ml EDTA lavande (06) 1,8 ml bleu clair (07) 8,5 ml rouge/gris (01) 8,5 ml rouge/gris (05 ou 04)1 5,0 ml jaune SST (08) 8,5 ml rouge/gris (11) |
Centrifuger à 2900 tr/min pendant 15 minutes à 17 ºC |
| Après la centrifugation | 6,0 ml lavande (03 ou 02)1 3,0 ml rouge (99) 8,5 ml rouge/gris (01) 8,5 ml rouge/gris (05 ou 04)1 5,0 ml jaune SST (08) 8,5 ml rouge/gris (11) 2,0 ml gris clair (02 ou 05)1 6,0 ml lavande (04 ou 03)1 10,0 ml EDTA lavande (06) 1,8 ml bleu clair (07) |
Grouper les échantillons dans l’ordre suivi pour prélever les aliquotes Faire la répartition immédiatement ou mettre le support pour tubes dans le réfrigérateur (voir la note) |
| 1. Pour ce qui est de l’ordre des tubes, le premier numéro est celui appliqué pour les répondants à jeun et le second, pour les répondants non à jeun. | ||
Tous les échantillons étaient centrifugés dans les deux heures et répartis en aliquotes dans les quatre heures après le prélèvement de sang. La répartition en aliquotes pour le test 132 (homocystéine) était effectuée dans l’heure et demie après le prélèvement de sang.
8.4.1 Manipulation du sérum
Le nombre maximal de tubes de sérum qui pouvaient être prélevés était de quatre, selon l’âge du répondant et son admissibilité aux analyses. Le sérum provenant des tubes SST (rouge/gris et jaune) était d’abord regroupé dans une bouteille préétiquetée de 30 ml Nalgene avant sa répartition en aliquotes dans des tubes d’échantillon individuels.
Le phlébotomiste devait suivre les instructions suivantes pour la manipulation du sérum :
-
Après la centrifugation, inspecter tous les tubes afin de déceler tout brin de fibrine qui aurait pu rester dans le sérum. Si des brins de fibrine sont visibles, les retirer de l’échantillon à l’aide d’un applicateur en bois et jeter l’applicateur dans le sac réservé à l’élimination des produits biologiques dangereux. S’assurer que le gel a séparé les cellules et le sérum comme il se doit.
-
Répéter l’étape ci-dessus pour chaque tube de prélèvement de sérum (tous les tubes de prélèvement à bouchon rouge/gris et jaune).
-
Décanter le sérum contenu dans chaque tube de prélèvement de sérum dans la bouteille de mélange de sérums. Le gel de séparation empêchera que les globules rouges décantent. Extraire autant de sérum que possible de chaque tube de prélèvement.
Nota : Éviter de mélanger des sérums qui sont moyennement ou fortement hémolysés. Garder ces tubes à part et les utiliser pour des analyses telles que le dépistage de l’hépatite et le profil des lipides pour lesquelles l’hémolyse ne pose pas de problème. Le sérum légèrement hémolysé peut être versé dans la bouteille de mélange de sérums. -
Visser fermement le bouchon de la bouteille de mélange de sérums et homogénéiser le contenu en le faisant tourbillonner énergiquement ou en inversant la bouteille deux ou trois fois.
-
Inscrire si l’échantillon transféré dans la bouteille de mélange de sérums présente un problème.
-
Mettre la bouteille de côté jusqu’au moment où peut être faite la répartition dans des tubes d’échantillon.
8.5 Traitement des échantillons
Les échantillons ont été traités aussitôt que possible afin qu’ils conservent leur plus haute intégrité.
8.5.1 Répartition du sang total
| Type de tube de prélèvement | Numéro d’identification du test | Nom du test | Âge (années) | Volume souhaité d’échantillon (ml) | Volume minimal d’échantillon (ml) | Capacité du tube d’échantillon (ml) | Type de tube d’échantillon | Couleur du bouchon |
|---|---|---|---|---|---|---|---|---|
| 6,0 ml EDTA | 111 | Hémoglobine glyquée | 6 à 79 | 1,5 | 1,0 | 2,0 | Nalgene | Transparent |
| 112 | Folate dans les globules rouges | 6 à 79 | 0,2 | 0,1 | 2,0 | VWR Cryogénique | Orange | |
| 511 ou 512 |
Dépistage des métaux 1 | 6 à 79 | 2,0 | 0,8 | 2,0 | Nalgene | Transparent | |
| Dépistage des métaux 2 | 6 à 79 | 2,0 | 1,3 | 2,0 | Nalgene | Transparent | ||
| 10,0 ml EDTA1 | 09 | ADN | 20 et plus | 10,0 | S.O. | 10,0 | Tube de prélèvement | Lavande |
| 10,0 ml EDTA1 | 10 | ADN | 20 et plus | 10,0 | S.O. | 10,0 | Tube de prélèvement | Lavande |
| 1. Les tubes de 10,0 ml contenant de l’EDTA ne sont pas répartis en aliquotes. | ||||||||
8.5.2 Répartition du plasma
| Type de tube de prélèvement | Numéro d’identification du test | Nom du test | Âge (années) | Volume souhaité d’échantillon (ml) | Volume minimal d’échantillon (ml) | Capacité du tube d’échantillon (ml) | Type de tube d’échantillon | Couleur du bouchon |
|---|---|---|---|---|---|---|---|---|
| 2,0 ml Gris clair |
131 | Glucose | 6 à 79 | 1,0 | 0,3 | 2,0 | VWR Cryogénique | Bleu |
| 6,0 ml Lavande | 132 | Homocystéine1 | 6 à 79 | 1,0 | 0,4 | 2,0 | VWR Cryogénique | Orange |
| 133 | Vitamine D | 6 à 79 | 1,0 | 0,5 | 2,0 | VWR Cryogénique | Vert | |
| 931 | Plasma entreposé 1 | 6 à 79 | 0,5 | S.O. | 0,5 | VWR SuperClear | Violet/ blanc | |
| 10,0 ml Lavande2 | 531 | PBDE + pesticides organochlorés + BPC non coplanaires | 20 à 79 (à jeun) (2 500) |
2,7 | 2,2 | 7,0 | Fiole de verre Supelco | Noir |
| 532 | Composés perfluorés | 20 à 79 | 1,8 | 1,2 | 2,0 | VWR Cryogénique | Rouge | |
| 1,8 ml Bleu clair |
134 | Fibrinogène | 12 à 79 | 0,5 | 0,2 | 2,0 | VWR Cryogénique | Brun roux |
| 1. L’échantillon pour l’analyse de l’homocystéine était réparti en aliquotes dans l’heure et demie après le prélèvement de sang et les aliquotes étaient congelées immédiatement après. 2. Les tests 531 et 532 ont été faits à partir de sous‑échantillons, de sorte que tous les répondants n’y étaient pas admissibles. |
||||||||
8.5.3 Répartition du mélange de sérum
| Type de tube de prélèvement | ID du test | Nom du test | Âge (années) | Volume souhaité d’échantillon (ml) | Volume minimal d’échantillon (ml) | Capacité du tube d’échantillon (ml) | Type de tube d’échantillon | Couleur du bouchon |
|---|---|---|---|---|---|---|---|---|
| Mélange de sérums provenant des tubes SST (bouteille de 30 ml) | 151 | Profil des lipides | 6 à 79 (à jeun) | 1,0 | 0,5 | 2,0 | VWR Cryogénique | Rose |
| 152 | Insuline | 6 à 79 (à jeun) | 0,5 | 0,3 | 2,0 | VWR Cryogénique | Orange | |
| 153 | Batterie d’analyses chimiques | 6 à 79 | 1,0 | 0,5 | 2,0 | VWR Cryogénique | Bleu | |
| 154 | Protéine C-réactive | 6 à 79 | 0,5 | 0,2 | 2,0 | VWR Cryogénique | Bleu | |
| 155 | Vitamine B12 | 6 à 79 | 0,7 | 0,4 | 2,0 | VWR Cryogénique | Orange | |
| 351 ou 352 |
Batterie de tests de dépistage de l’hépatite 1 | 14 à 79 | 1,0 | 0,5 | 3,0 | Fisherbrand | Transparent joint torique rouge | |
| Batterie de tests de dépistage de l’hépatite 2 | 14 à 79 | 2,0 | 0,5 | 3,0 | Fisherbrand | Transparent joint torique rouge | ||
| 951 | Sérum entreposé 1 | 6 à 79 | 0,5 | S.O. | 0,5 | VWR SuperClear | Violet Jaune |
|
| 952 | Sérum entreposé 2 | 6 à 79 | 0,5 | S.O. | 0,5 | VWR SuperClear | Violet Jaune |
|
| 953 | Sérum entreposé 3 | 6 à 79 | 0,5 | S.O. | 0,5 | VWR SuperClear | Violet Jaune |
|
| 954 | Sérum entreposé 4 | 6 à 79 | 0,5 | S.O. | 0,5 | VWR SuperClear | Violet Jaune |
|
| 955 | Sérum entreposé 5 | 12 à 79 | 0,5 | S.O. | 0,5 | VWR SuperClear | Violet Jaune |
|
| 956 | Sérum entreposé 6 | 12 à 79 | 0,5 | S.O. | 0,5 | VWR SuperClear | Violet Jaune |
|
| 957 | Sérum entreposé 7 | 12 à 79 | 1,0 | S.O. | 2,0 | VWR Cryogénique | Jaune | |
| 958 | Sérum entreposé 8 | 12 à 79 | 1,0 | S.O. | 2,0 | VWR Cryogénique | Jaune | |
| 959 | Sérum entreposé 9 | 12 à 79 | 1,0 | S.O. | 2,0 | VWR Cryogénique | Jaune |
8.6 Entreposage des échantillons
Les échantillons étaient entreposés dans le réfrigérateur ou dans le congélateur du laboratoire du centre d’examen mobile, selon l’analyse qui devait être effectuée, et étaient expédiés une fois par semaine (deux fois par semaine pour l’ADN) aux laboratoires de référence. Tous les échantillons étaient entreposés aussitôt que le traitement était terminé.
Pour plus de renseignements concernant les procédures opératoires normalisées du laboratoire, veuillez communiquer avec l'Enquête canadienne sur les mesures de la santé au 1-888-253-1087 ou à chms-ecms@statcan.gc.ca.
9. Composante du moniteur d’activité (AM)
Les moniteurs d’activité, aussi appelés accéléromètres, sont des dispositifs électroniques à pile, de la taille d’un téléavertisseur, qui se portent à la ceinture. Ces dispositifs enregistrent un nombre de mouvements par minute proportionnel à l’intensité moyenne du mouvement (c.-à-d. l’accélération) durant la minute en question.
9.1 Équipement
- Moniteur d’activité Actical.
- Ceinture ajustable jetable.
9.2 Admissibilité
- Les répondants de 6 à 79 ans.
9.3 Critères d’exclusion
- Personnes en fauteuil roulant.
9.4 Administration du bloc moniteur d’activité
-
Les répondants qui ont accepté de participer à la composante du moniteur d’activité ont reçu un moniteur d’activité et une ceinture ajustable jetable de la taille appropriée. Si un répondant ne voulait pas porter un moniteur d’activité, on a inscrit la raison du refus.
-
Le spécialiste des mesures de la santé (SMS) a montré au répondant comment mettre la ceinture. Le moniteur d’activité a par la suite été placé sur la ceinture. La ceinture a été ajustée, afin que le moniteur d’activité se trouve au‑dessus de la hanche droite, la flèche pointant vers le haut. Le moniteur d’activité pouvait être porté par‑dessus ou sous les vêtements.
-
Le SMS a expliqué que le moniteur d’activité devait être porté à partir du lever du répondant tous les jours, et jusqu’à ce que le répondant soit prêt à s’endormir. Si le répondant lisait ou s’adonnait à une autre activité avant de s’endormir, il devait garder le moniteur d’activité sur lui. On a demandé au répondant de porter le moniteur d’activité pendant sept jours.
10. Bibliographie – Protocoles du cycle 1 de l’ECMS :
- Société canadienne de physiologie de l’exercice. 2003. Guide du conseiller en condition physique et habitudes de vie (Guide du conseiller CPHV). 3e édition. Ottawa.
- Ross, W. D. & M.J. Marfell-Jones. 1991.« Kinanthropometry » in Physiological Testing of the High-Performance Athlete, 2ième édition,. J. D. MacDougall, H. A. Wenger, & H. J. Green, eds., Human Kinetics Books, Champaign, Illinois, pp. 223-308.
- Condition physique et Sport amateur Canada. 1986. Physitest normalisé canadien (PNC), Manuel technique, troisième édition. Ottawa.
- STATISTIQUE CANADA. s.d. Enquête canadienne sur les mesures de la santé : Questionnaire de la partie clinique, 95 p.
www.statcan.gc.ca/cgi-bin/imdb/p2SV_f.pl?Function=getSurvey&SDDS=5071&lang=en&db=imdb&adm=8&dis=2 - Miller M.R., J. Hankinson, V. Brusasco et al. 2005. « Standardization of spirometry » Eur Respir, Vol. 26, pp. 319-338.
- Stephens, T. & C.L. Craig. 1985. « Fitness and activity measurement in the 1981 Canada Fitness Survey ». In: Drury, T. (ed.). 1989. Assessing physical fitness and activity patterns in general population surveys, Department of Health and Human Services, Public Health Service, Center for Disease Control, National Center for Health Statistics, Hyattsville, MD, pub. No. (PHS) 89-1253.
- Pour obtenir un exemplaire du « Manuel de l’enquête et critères de codage à l’intention du dentiste de l’Enquête canadienne sur les mesures de la santé de 2006‑2008 » veuillez communiquer avec l’Enquête canadienne sur les mesures de la santé au 1-888-253-1087 or chms-ecms@statcan.gc.ca.
- Campbell, Norm R.C., Joffre Michel R., McKayDonald W. 2005. « Hypertension Surveillance in Canada: Minimum Standards for Assessing Blood Pressure in Surveys. » Canadian Journal of Public Health. Vol. 96, no 3, pp. 217-220.
Annexe 5 : Documentation des variables dérivées
Pour plus de renseignements concernant la documentation des variables pour la vague 1 : Enquête canadienne sur les mesures de la santé (ECMS) Cycle 1 Vague 1. Spécifications des variables dérivées (VD).
Pour plus de renseignements concernant la documentation des variables pour la vague 2 : Enquête canadienne sur les mesures de la santé (ECMS) Cycle 1 Vague 2. Spécifications des variables dérivées (VD)
Pour plus de renseignements concernant la documentation des variables pour la vague 3 : Enquête canadienne sur les mesures de la santé (ECMS) Cycle 1 Vague 3. Spécifications des variables dérivées (VD)
Pour plus de renseignements concernant la documentation des variables pour la vague 4 : Enquête canadienne sur les mesures de la santé (ECMS) Cycle 1 Vague 4. Spécifications des variables dérivées (VD)
Pour plus de renseignements concernant la documentation des variables pour la diffusion des données supplémentaire : Enquête canadienne sur les mesures de la santé (ECMS) Cycle 1 diffusion des données supplémentaire. Spécifications des variables dérivées (VD)
Annexe 6 : Questionnaires
Pour plus de renseignements concernant les questionnaires : Questionnaire(s) et guide(s) de déclaration – Enquête canadienne sur les mesures de la santé (ECMS).
